Nano Res.│福州大学杨黄浩课题组:基于核酸适体的人工酶用于糖酵解和氧化磷酸化双抑制的肿瘤协同治疗
本篇文章版权为杨黄浩课题组所有,未经授权禁止转载。
背景介绍
充足的能量供应是肿瘤细胞不受控制地增殖、浸润和转移的必要条件。为了满足能量需求,肿瘤细胞会进行代谢重编程,以上调糖酵解活性,并保留了绝大部分的氧化磷酸化活性。活跃的糖酵解和氧化磷酸化为肿瘤细胞提供了充足的ATP以满足能量供应,因此它们也是肿瘤治疗中最热门的靶点之一。但是单独的糖酵解抑制或氧化磷酸化抑制受到肿瘤细胞代谢可塑性的限制而难以发挥满意的疗效。相比之下,糖酵解和氧化磷酸化的协同抑制在肿瘤消除方面显示出更大的潜力。然而,常规的多药联合方法往往存在药代动力学之间的差异,使多种药效的发挥难以在时间和空间上达成一致。
针对此研究难点,杨黄浩教授、卢春华教授团队创新性地使用核酸适体构建功能化的人工酶,以催化肿瘤细胞内的精氨酸向一氧化氮的转化,并将其应用于糖酵解和氧化磷酸化的同时抑制,取得了非常好的协同效果。这一全新策略通过利用适体功能化的人工酶进行细胞内原位催化反应,实现两条细胞通路时空一致的调控,提供了一种肿瘤协同治疗的新策略。
研究方法 适体功能化的人工酶由精氨酸适体和碳点掺杂的石墨相氮化碳共价偶联来构建。基于适体与底物精氨酸的特异性结合,人工酶可以循环捕获细胞内的精氨酸,从而提高精氨酸的局部浓度,延长精氨酸在人工酶上的保留时间。碳点掺杂的石墨相氮化碳作为光催化剂,在660 nm激光照射下可催化富集的精氨酸氧化生成一氧化氮。精氨酸适体和碳点掺杂的石墨相氮化碳分别作为人工酶的底物结合位点和催化活性中心,赋予人工酶催化特异性和高效性。在复杂的细胞内环境中,人工酶在激光照射下催化细胞内精氨酸氧化并产生一氧化氮。肿瘤细胞内精氨酸的耗竭进一步阻碍M2型丙酮酸激酶的合成,从而降低糖酵解活性;一氧化氮的产生进一步导致线粒体损伤,从而干扰氧化磷酸化过程。糖酵解和氧化磷酸化的双重抑制共同阻断肿瘤细胞的ATP合成,协同抑制能量供应并诱导肿瘤细胞凋亡。 成果简介 杨黄浩教授、卢春华教授团队开发了一种核酸适体功能化的人工酶,用于肿瘤的双通路协同治疗。核酸适体作为底物结合位点与催化活性中心共价结合,赋予该人工酶催化特异性和高效性,使其能够在复杂的细胞环境内催化内源性精氨酸氧化为一氧化氮。肿瘤细胞内的精氨酸耗竭和一氧化氮生成分别抑制糖酵解和氧化磷酸化,从而实现肿瘤细胞能量供应的协同阻断,提供一种人工酶调控细胞通路的新策略。 核酸适体功能化人工酶的构建与应用 作者简介 杨黄浩,福州大学教授。2011年获国家杰出青年科学基金, 2014年入选国家万人计划,2014年入选英国皇家化学会会士,2015年入选全国先进工作者。曾任福州大学化学学院副院长、生物科学与工程学院院长、教育部重点实验室主任,现任福州大学副校长、教育部创新团队带头人、福建省工程研究中心主任。在科学研究方面,围绕分析化学、纳米医学、生物医学工程等领域进行了较为深入的研究,在方法学和实际应用方面取得了系统性的创新研究成果。已主持国家973计划课题1项、国家863计划课题2项、国家重大科学仪器设备开发专项课题1项、国家自然科学基金重点项目2项。已发表学术论文180余篇,其中发表在Nature、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Adv. Mater.等影响因子大于10刊物的论文50余篇。发表论文总引用次数超过25000次(H因子=80),单篇论文最高被引用2300余次。 卢春华,福州大学化学学院教授、博士生导师。2001-2011年就读于福州大学,2005年获得学士学位,2011年获得博士学位,2011-2015年在以色列耶路撒冷希伯来大学从事博士后研究工作。2013年获得全国优秀博士学位论文提名奖,2014年入选福建省“闽江学者”特聘教授,2015年入选海外高层次人才引进计划、福建省第四批引进高层次创业创新人才计划(百人计划),2017年获福建省青年科技奖。主要从事生命分析化学与纳米医学基础及应用研究。主持和参与国家重点研发计划课题、国家自然科学基金面上项目、国家基金-海峡联合基金项目,在纳米分子影像探针,纳米生物传感新技术,DNA超分子纳米结构和纳米机器等方面已发表SCI论文90余篇。研究论文总共被引用8000余次。 文章信息 X. Fang, M. Yuan, J. Dai, et al. Dual inhibition of glycolysis and oxidative phosphorylation by aptamer-based artificial enzyme for synergistic cancer therapy. Nano Research. https://doi.org/10.1007/s12274-022-4237-2. 识别二维码或点击左下角“阅读原文”可访问全文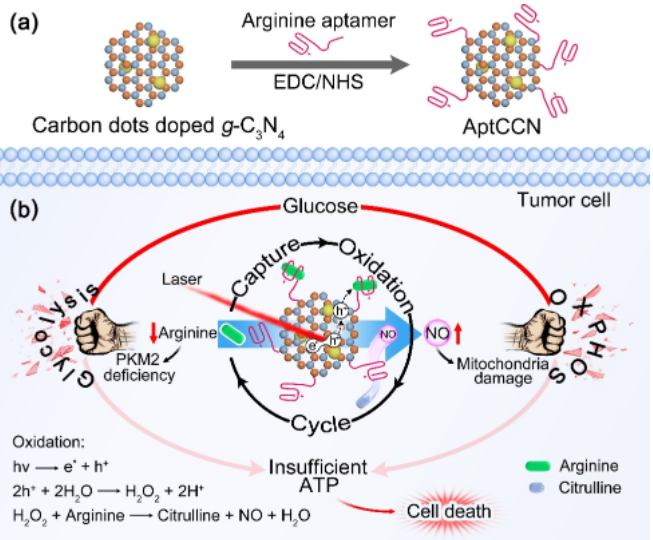


如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号