南佛罗里达大学蔡健峰团队PNAS:利用Sulfonyl-γ-AA螺旋拟肽稳定Aβ螺旋
目前一种普遍的假设认为,β-淀粉样蛋白(Aβ)寡聚化是与阿尔茨海默病(AD)的发生和进展相关的主要特征,因此人们付出了相当多的努力来开发针对Aβ寡聚化的分子探针和治疗药物。近日,南佛罗里达大学蔡健峰教授(点击查看介绍)课题组在PNAS 上发表论文,阐述了通过合理设计和优化基于螺旋Sulfonyl-γ-AApeptide的配体来抑制Aβ42聚集的策略。与先前设计的模拟β-折叠片段以防止Aβ片段生长和纤维化的肽不同,他们提出了设计Sulfonyl-γ-AApeptide 非天然螺旋折叠拟肽的策略,这些拟肽能够特异性地识别Aβ螺旋,从而调节Aβ的构象为非通路结构,以避免形成神经毒性的Aβ寡聚体纤维(Figure 1)。

Figure 1. The structure of sulfonyl-γ-AApeptides and their use as ligands to stabilize helical structure of Aβ peptide. (a) Chemical structure of sulfonyl-γ-AApeptide. ‘a’ and ‘b’ represent the chiral side chain and sulfono side chain, respectively. (b) and (c) are the side view and top view of sulfonyl-γ-AApeptide foldamer. (d) The schematic illustration of helical Aβ peptide stabilized by ligands.
蔡健峰课题组长期致力于新型非天然拟肽的开发、研究及应用。在近年来该团队独立设计开发了一类螺旋折叠体拟肽-Sulfonyl-γ-AApeptides,并利用该拟肽来模拟α-螺旋肽来调节疾病相关的蛋白质-蛋白质相互作用(Chem. Soc. Rev. 2023, 52, 4843; J. Am. Chem. Soc. 2023, 145, 20009; ACS Cent. Sci. 2023, 9, 1046; J. Am. Chem. Soc. 2022, 144, 270; Acc. Chem. Res. 2020, 53, 2425; Sci. Adv. 2020, 6, eaaz4988; PNAS 2019, 116, 10757)。基于 Sulfonyl-γ-AA拟肽的结构和生物稳定性,该研究团队认为其可以被利用来识别和稳定Aβ螺旋构型。Aβ寡聚体纤维被认为与AD密切相关,但是Aβ螺旋构型被认为是无害的。为了便于配体的设计,他们在Aβ上划分了三个可能对于设计识别和稳定Aβ螺旋的关键结构域,包括阳离子结构域1、疏水结构域2和阴离子结构域3;这种设计后来被证明是成功的。他们最初专注于阳离子结构域1(Q15、K16)和疏水结构域2(F19和F20)。基于这两个结构域,他们确定了Ab-3作为潜在的拮抗剂。在后来着手设计以针对所有三个结构域的分子时,他们发现Ab-6是对Aβ42聚集最有效的配体 (Figure 2)。Ab-6不仅能够防止Aβ聚集,还能破坏已形成的Aβ纤维核。
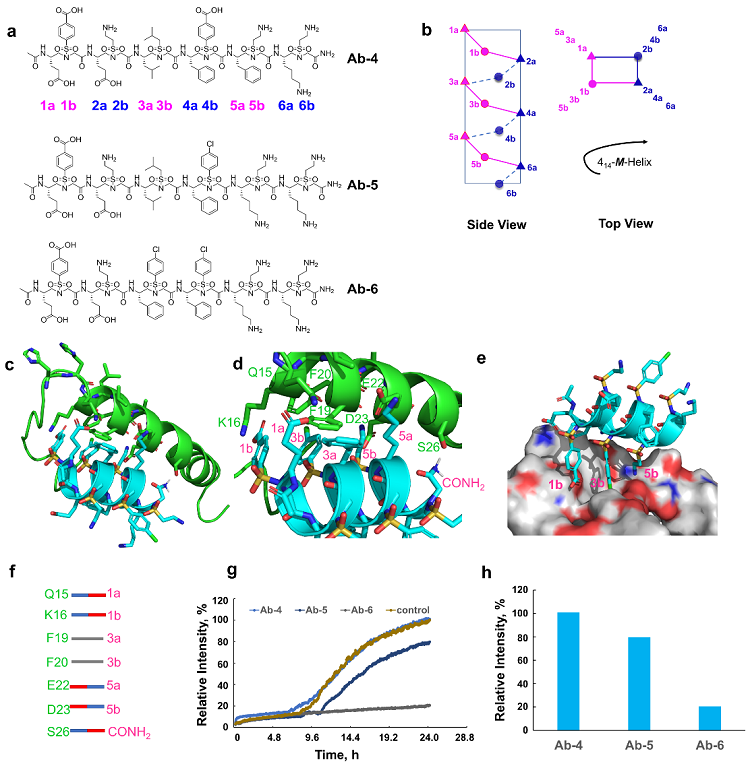
Figure 2. Design of sulfonyl-γ-AApeptides targeting Aβ. (a) Chemical structures of sulfono-γ-AApeptides Ab-4, Ab-5, Ab-6. (b) Helical wheel of sulfono-γ-AApeptides to illustrate the distribution of side chains. (c-f) proposed PPI between Ab-6 and the Aβ helix. (c) side view. (d) closed view. (e,f) Hypothesized electrostatic and hydrophobic interactions between side chains. (g,h) Kinetic profile of 10 μM Aβ42 amyloid β-sheet formation in the absence (control) and presence of 10 µM Ab-4, Ab-5 and Ab-6, respectively.
生物物理学手段如ThT和TEM表明,在Sulfonyl-γ-AApeptide的作用下,Aβ寡聚化和纤维化可以得到很大程度的预防甚至逆转。基于圆二色光谱(CD)光谱和二维核磁共振的研究明确表明,Sulfonyl-γ-AApeptide Ab-6可以结合到Aβ42的中心区域,并在Aβ中诱导α-螺旋构象。其中,循环二色光谱谱分析表征了由于Ab-6的存在而引起的二级结构诱导。在没有Ab-6的情况下,明显检测到从α-螺旋到β-折叠的构象转变。在等摩尔Ab-6存在的情况下,α-螺旋构象在整个实验过程中成为主要种属。1H-15N HSQC 2D-NMR谱显示了Aβ的三个结构域中的明显位移。此外,ESI-IMS-MS分析有助于调查Aβ42聚集和抑制的细节,表明Ab-6和Aβ42在多个电荷状态下特异性相互作用,而不是随机和非特异性相互作用(Figure 3)。Ab-6与Aβ42之间的相互作用在细胞环境中保持。同样,发现Ab-6能够改善由于Aβ42聚集引起的细胞毒性,具有预防和逆转预先形成的Aβ42聚集的细胞毒性的能力。共聚焦显微镜研究表明,Ab-6和Aβ42可以共定位在线粒体中,这可能解释了其在细胞环境中与Aβ42相互作用并拯救由Aβ42引起的线粒体损伤所具有的能力。综合而言,研究表明,Sulfonyl-γ-AApeptide作为螺旋拟肽可以将Aβ引导到非通路的螺旋次级结构,从而防止Aβ聚集以及由此产生的神经细胞毒性。

Figure 3. Investigation of Ab-6 binding to Aβ42 using NMR and ESI-MS. (a) Time-course 1H NMR spectra where the spectra were recorded at 0h, 6h and 24h respectively with 40 μM Aβ42 and (b) with 2.5 eq of Ab-6. (c) Overlay of the 1H-15N HSQC 2D-NMR spectra of 40 µM 15N- Aβ42 alone (black) and with Ab-6 at a stoichiometric ratio of 1: 2.5 (15N-Aβ42: Ab-6). (d) Change of chemical shift in the presence of Ab-6. nd: not detected. (e) DOSY NMR of Aβ42 alone (40 μM). (f) DOSY NMR of Aβ42 with Ab-6 at a stoichiometric ratio of 1: 2.5. (g) DOSY experimental analyses on the peak at 0.68 ppm derived from Aβ42 with and without Ab-6. (h) The sequence of Aβ42 . (i) ESI-MS mass spectrum of Aβ42 alone at 0 h. (j) ESI-MS mass spectrum showing Ab-6 added at 110 μM to Aβ42 at 22 μM (denoted as ALx+, where A is Aβ42, L is Ab-6, x is the charge state). (k) ESI-IMS-MS Driftscope plot of Aβ42 at 22 μM in H2O showing IMS drift time versus m/z versus intensity. (l) ESI-IMS-MS Driftscope plot of Aβ42 (22 μM) and Ab-6 (110 μM) in H2O showing IMS drift time versus m/z versus intensity.
综上所述,在这篇文章中,蔡健峰研究团队设计了Sulfonyl-γ-AA螺旋拟肽以诱导和稳定Aβ中的α-螺旋构象。通过利用一系列的SAR研究和生物物理学分析,如圆二色光谱(CD)、动态光散射(DLS)、二维和DOSY核磁共振(NMR)、ESI-IMS-MS,他们成功地确定了一种先导化合物Ab-6。Ab-6能够与Aβ中的多个结构域特异性相互作用,并将Aβ稳定为主要的α-螺旋构象。由Ab-6稳定的Aβ结构是无毒的,不表现出朊样特性。这些研究揭示了Aβ上的潜在结合位点,为设计更有效的Aβ拮抗剂提供了见解。在体外和细胞环境中破坏Aβ的前纤维体能力使Ab-6成为治疗AD的潜在药物。此外,有理由相信诱导Aβ中的二级结构的策略,以及为蛋白质/肽识别设计磺酰基-γ-AA肽的策略,可以应用于对抗其他淀粉样蛋白。
本文的主要工作由蔡健峰课题组博士研究生刘衡完成,并得到了南佛罗里达大学叶立斌教授还有其他几位教授及课题组的指导和帮助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Helical sulfonyl-γ-AApeptides modulating Aβ oligomerization and cytotoxicity by recognizing Aβ helix
Heng Liu, Yunpeng Cui, Xue Zhao, Lulu Wei, Xudong Wang, Ning Shen, Timothy Odom, Xuming Li, William Lawless, Kanchana Karunarathne, Martin Muschol, Wayne Guida, Chuanhai Cao, Libin Ye, and Jianfeng Cai*
PNAS, 2024, DOI: 10.1073/pnas.2311733121
蔡健峰课题主页:
http://jianfengcai.myweb.usf.edu/
https://www.x-mol.com/university/faculty/47852
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号