CYP121酶中底物和过氧化物结合的高自旋铁-过氧化氢中间体的原位结构测定
铁-过氧化氢(Fe-OOH, 又称为Compound 0, 缩写为cpd 0)是常见的反应中间体。基于铁血红素的Fe-OOH具有六配位的空间构型因此通常为低自旋态。在过去几十年里,关键的铁-过氧化氢中间体已被提议用于所有基于血红素的氧化化学,可以用于形成活性氧化物种,更少见的情况下还可用作活性物种。由于其高度瞬态的特性,研究者直到2021年早些时候才在组氨酸配体系统中使用非天然底物首次实现结构化捕获(J. Am. Chem. Soc., 2021, 143, 4680–4693,点击阅读详细)。到目前为止,在生物催化系统中,更具反应性的硫醇酸配体的铁-过氧化氢结构仍然未知。
早在2017年,德州大学圣安东尼奥分校的Feradical(Aimin Liu,刘爱民教授)团队就在研究中结核分枝杆菌的P450酶CYP121时发现了一个前所未有的高自旋态反应中间体(J. Biol. Chem., 2017, 292, 13645-13657)。这个高自旋态反应中间体是酶与天然底物结合后于过氧乙酸(CH3CO3H)反应后形成的中间体。刘爱民教授团队对这个非同寻常的自旋态cpd 0非常感兴趣,一直致力于找出六配位血红素Fe-OOH为什么是高自旋态而非通常为低自旋态的结构合理性。遗憾的是,现有的技术手段都不可能给出答案。他们与劳伦斯伯克利国家实验室合作开发并改进了一种用于蛋白质晶体内反应的毫秒级快速混合方法,加上利用X-射线自由电子激光串行飞秒晶体学(SFX-XFEL)技术,达到了室温下直接测定毫秒时间段反应中间体晶体结构的技术突破。值得一提的是,无需在结构测定的任何步骤中进行冷冻。
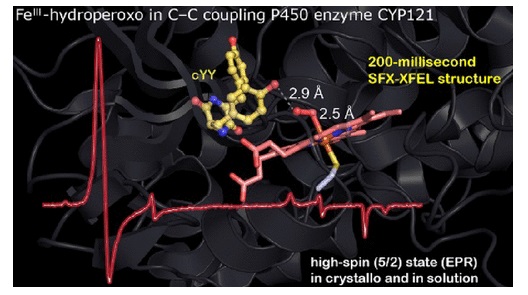
利用时间分辨的快速混合SFX-XFEL直接结构测定技术,刘教授和合作者们首次在原位观察到与天然底物结合的P450酶CYP121铁-过氧化氢中间体。其结构揭示了过氧化氢配体并非通常与铁端对接的结合模式,而是两个氧原子从侧面结合。这样一来,过氧化氢配体在铁中心的上端同时与铁松散地作用,形成一个拟似七配位的铁-过氧化氢中间体。这个非同寻常的空间构型导致了高自旋态。时间分辨的单晶晶体浆料电子顺磁共振(single-crystal EPR)确认了这个拟似七配位的铁-过氧化氢中间体就是高自旋态,和2017年用液态反应超速冷却法观察到的是同一中间体。高自旋态的化学基础表明它在该酶催化的C–C键合反应中起着直接氧化剂的作用。的确,在200毫秒反应中间体SFX-XFEL结构中,过氧化氢配体也同时与结合的天然底物作用。基于这些结果,该文提出了一种新的C–C键合反应机理。
综上,这项工作所报告的cpd 0中间体结构先前工作的重大进展。首先,在反应过程中,在室温下没有进行任何淬灭或捕获直接测定了200毫秒中间体结构。其次,过氧化氢基团以与非羟基化化学相关的独特结合模式存在,表明结核分枝杆菌酶CYP121利用独特定位的高反应性铁-过氧化氢中间体作为C–C键形成反应的关键氧化剂。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

In Situ Structural Observation of a Substrate- and Peroxide-Bound High-Spin Ferric-Hydroperoxo Intermediate in the P450 Enzyme CYP121
Romie C. Nguyen, Ian Davis, Medhanjali Dasgupta, Yifan Wang, Philipp S. Simon, Agata Butryn, Hiroki Makita, Isabel Bogacz, Kednerlin Dornevil, Pierre Aller, Asmit Bhowmick, Ruchira Chatterjee, In-Sik Kim, Tiankun Zhou, Derek Mendez, Daniel W. Paley, Franklin Fuller, Roberto Alonso Mori, Alexander Batyuk, Nicholas K. Sauter, Aaron S. Brewster, Allen M. Orville, Vittal K. Yachandra, Junko Yano, Jan F. Kern*, and Aimin Liu*
J. Am. Chem. Soc., 2023, DOI: 10.1021/jacs.3c04991
导师介绍
刘爱民(Feradical)教授是一位分子生物化学家和生物物理学家,他所领导的团队致力于理解金属蛋白结构与功能关系以及研究在生物学中涉及氧活化和电子/自由基转移过程的蛋白质自由基。他在生物化学、生物无机化学、生物物理学、生物信息学和化学生物学等领域拥有广泛的背景,是蛋白化学、酶学、以电子顺磁共振为中心的生物物理光谱学、化学生物学以及分子和结构生物学方面的专家。这种混合背景创造了一个有利于跨学科研究的环境,为机制酶学和蛋白质化学的原创性贡献带来了一些新概念的发展,比如生物电荷共振稳定现象。
刘爱民教授在中国科学技术大学获得学士学位,并在中国科学院兰州化学物理研究所接受培训。他曾担任英国纽卡斯尔大学Sykes教授(FRS)实验室的皇家学会研究员。1999年,他在瑞典斯德哥尔摩大学获得生物物理学博士学位,师从Gräslund教授。1999年6月,他来到美国,在明尼苏达大学进行博士后研究,在John D. Lipscomb教授和Larry Que教授指导下从事非血红素铁氧酶蛋白的研究。2002年10月,他在密西西比医学中心生物化学系任终身聘任助理教授,此后获得晋升及终身教职后,他转到了乔治亚州立大学,在2012年提前晋升为正教授,并在2015年再次提前晋升为大学杰出讲座教授。2016年1月,他被聘为圣安东尼奥大学化学和生物化学教授,并担任Lutcher Brown杰出生物化学讲座教授。刘爱民教授在含铁蛋白和生物学中自由基领域的研究为他赢得了一个独特的学术绰号“Feradical”。他的工作一直受到美国国立卫生研究院(多个R01和R21)、多个国家科学基金会奖和其他资助机构的持续资助。他在《美国国家科学院院刊》(PNAS)、《美国化学学会期刊》(JACS)、《生物化学杂志》(JBC)、《生物化学》、《德国应用化学》(Angew Chem)、《化学科学》、《自然》集团期刊和其他同行评议的科学期刊上发表了许多研究论文。他曾担任许多期刊和资助机构的评审人,包括曾任美国国立卫生研究院Study Section常任成员和现国家科学院化学Fellowship评审小组的成员。他曾获得杰出教师奖和乔治亚癌症学者奖。他是美国科学促进会AAAS(化学)的当选会士、皇家化学学会会士和圣安东尼奥大学杰出研究员学院的当选院士。在业余时间,他喜欢打羽毛球。更多信息,请访问:https://Feradical.utsa.edu
https://www.x-mol.com/university/faculty/5229
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!













































 京公网安备 11010802027423号
京公网安备 11010802027423号