活化万古霉素:通过“衍生-增敏”(DeForSe)策略实现协同增强的膜靶向机制
注:文末有研究团队简介及本文科研思路分析
多药耐药性革兰氏阴性菌(如鲍曼不动杆菌)是细菌性感染临床治疗的重大挑战。造成这个困境的重要原因是革兰氏阴性菌特有的外膜(outer membrane)能有效降低许多临床抗生素的在细菌中的积累,造成其失效。此类抗生素一般称为窄谱的阳性菌抗生素,常见的例子有万古霉素、利奈唑胺、红霉素等(图1A)。为了增强阳性菌抗生素对阴性菌的杀伤能力,研究者们通常采用以下两种策略:(1)以亲脂性或阳离子基团修饰抗生素,以增强其膜亲和力(即衍生,derivatization),以及(2)将抗生素与具有外膜扰动能力的增敏佐剂联用以增强其细胞摄取(即增敏,sensitization)。然而,衍生和增敏两种策略对于分子体积较大、亲水性较强的抗生素(如万古霉素)效果欠佳,原因是没有做到对外膜的直接破坏。
如图1所示,近日,湖南大学冯欣欣(点击查看介绍)课题组与中科院上海药物研究所黄蔚(点击查看介绍)课题组、华中科技大学黄胜友(点击查看介绍)课题组合作,首次将“衍生”和“增敏”两种做法联合起来,开发了针对阳性菌抗生素广谱化的“衍生-增敏”(Derivatization for Sensitization, DeForSe)策略(图1B)。将这一策略应用于万古霉素,获得“万古霉素衍生物R4MOD2+对称阳离子(symmetric di-cationic structure,SymDiCat)洗必泰”的联合用药组合(图1C),在抑制鲍曼不动杆菌上取得了106倍至107倍的万古霉素活化效果。这种高度协同的抗菌效果,来源于DeForSe策略引入的协同增强膜靶向机制,造成直接的外膜破坏和抗生素分子的高效摄取。由于膜靶向机制的加入,该策略在实现阳性菌抗生素广谱化的同时,能有效抑制细菌耐药性的产生,实现抗菌药物的“抗耐药化”。

图1. 阴性菌的外膜结构以及DeForSe策略的设计。
如图2所示,为了寻找适合万古霉素的增敏佐剂,该团队通过筛选包含5717个化合物的商业化合物库寻找增敏剂的基础结构,并随后构建了含 C2h-symmetric di-cationic (SymDiCat)特征的增敏剂化合物库。这些增敏剂对万古霉素的增敏活性显示:具有C2h对称性,双胍基团和芳香端基3个特征的增敏剂能更好的增强万古霉素对鲍曼不动杆菌的活性。后续研究中选取增敏活性显著的洗必泰为候选增敏剂。
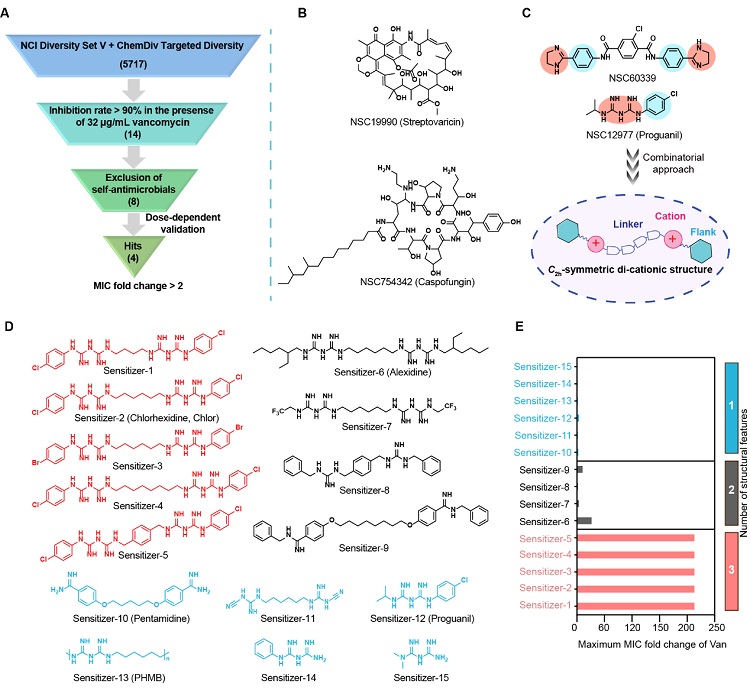
图2. 万古霉素增敏佐剂的筛选。A-C)通过筛选商业化合物库得到万古霉素增敏佐剂的基础结构。D)进一步合成的15个增敏佐剂结构。E)15个增敏佐剂对万古霉素的增敏活性。
如图3所示,为了使万古霉素能被上述增敏剂更好的活化,该团队进一步利用化学衍生的方法对万古霉素外围R1-R4四个位点用多种含末端联苯-硫鎓阳离子的基团进行改性,得到了对鲍曼不动杆菌活性最好的候选化合物R4MOD2。当将洗必泰与R4MOD2联合对抗鲍曼不动杆菌(即“衍生-增敏”策略)时,8 μg/mL的增敏剂洗必泰可将R4MOD2活性提高106倍,同时8 μg/mL的R4MOD2可以将洗必泰的活性提高20倍。这体现了修饰后的万古霉素导致阴性菌外膜的适度局部渗透,并使得洗必泰和外膜之间的相互作用更强,两者产生相互的协同作用。
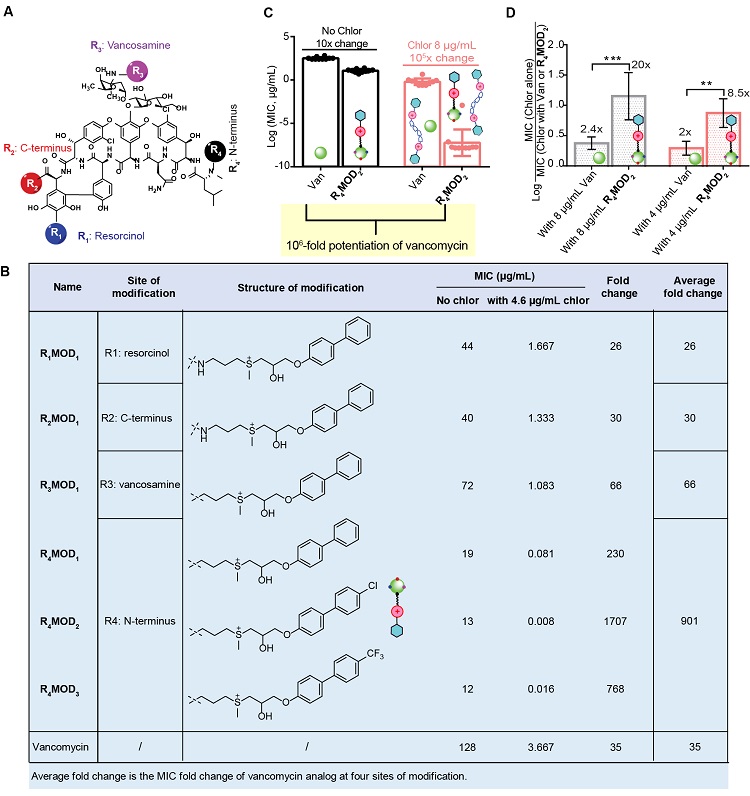
图3. 万古霉素衍生物的优化筛选以及DeForSe组合的抗菌测试。A-B)化学修饰万古霉素的结构示意图;万古霉素衍生物单独及其与增敏剂联用对鲍曼不动杆菌的活性。C-D)DeForSe组合的抗菌能力测试。
如图4-6所示,研究团队认为“衍生-增敏”策略产生的洗必泰-R4MOD2药物组合对鲍曼不动杆菌的高活性来源于其对外膜增强的协同靶向作用。扫描电子显微镜(SEM)显示,无论在生长或非生长条件下,当洗必泰-R4MOD2药物组合处理鲍曼不动杆菌时,其均表现出明显的细胞膜破坏作用。与此同时碘化丙啶法也证实了该药物组合处理后,鲍曼不动杆菌的膜通透性最大。通过合成荧光标记的万古霉素,该团队还观察到洗必泰能显著增加万古霉素荧光标记物在细菌内的积累,且随着外膜被破坏,荧光万古霉素会以胞内聚集物的形式出现。此外,在外膜脂多糖(LPS)拯救实验中,洗必泰-R4MOD2药物组合的活性能最大程度的被外加LPS减弱;在等温滴定量热(ITC)实验中,洗必泰-R4MOD2药物组合与LPS结合会产生最多的热量;在分子动力学模拟模型中,洗必泰-R4MOD2药物组合与LPS的主要成分结合比万古霉素本身与之结合更稳定。由此,“衍生-增敏”策略能产生协同增强的外膜靶向作用得到了验证。
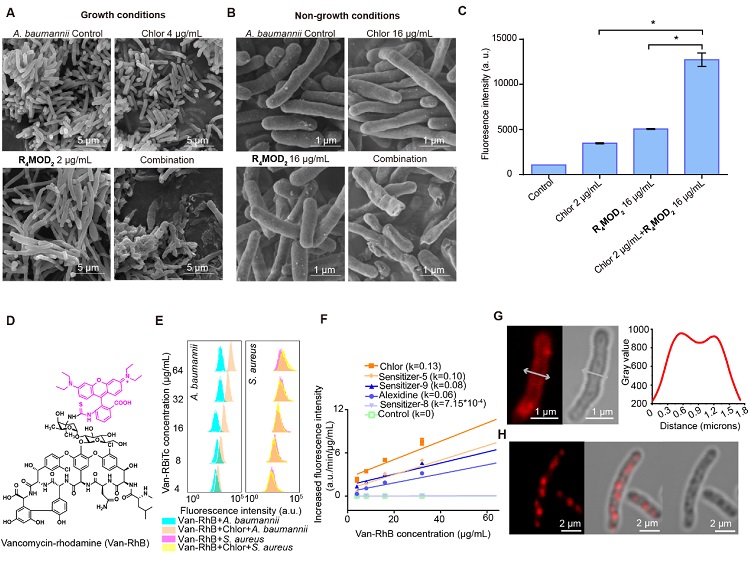
图4. R4MOD2-洗必泰组合具有额外的破膜机制。A-B)不同药物处理后鲍曼不动杆菌的SEM成像。C)碘化丙啶(PI)渗透性试验。D-F)洗必泰能促进万古霉素荧光标记物的胞内积累。G-H)有无洗必泰处理时,万古霉素荧光标记物在鲍曼不动杆菌中的定位。
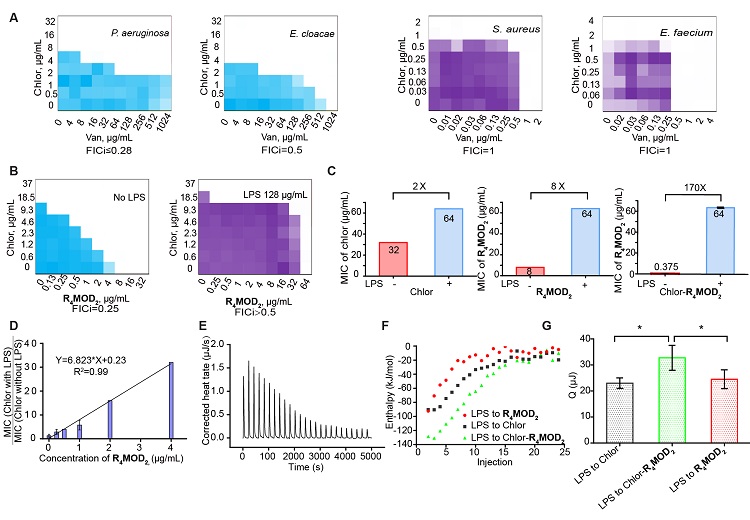
图5. 外膜成分LPS是R4MOD2-洗必泰组合破膜机制的分子靶标。A)洗必泰-R4MOD2组合只对含有LPS的革兰氏阴性菌有协同活性。B-D) LPS拯救实验,外加LPS能降低洗必泰-R4MOD2组合的活性。E-G)等温量热实验,洗必泰-R4MOD2组合与LPS结合释放出更的热量。
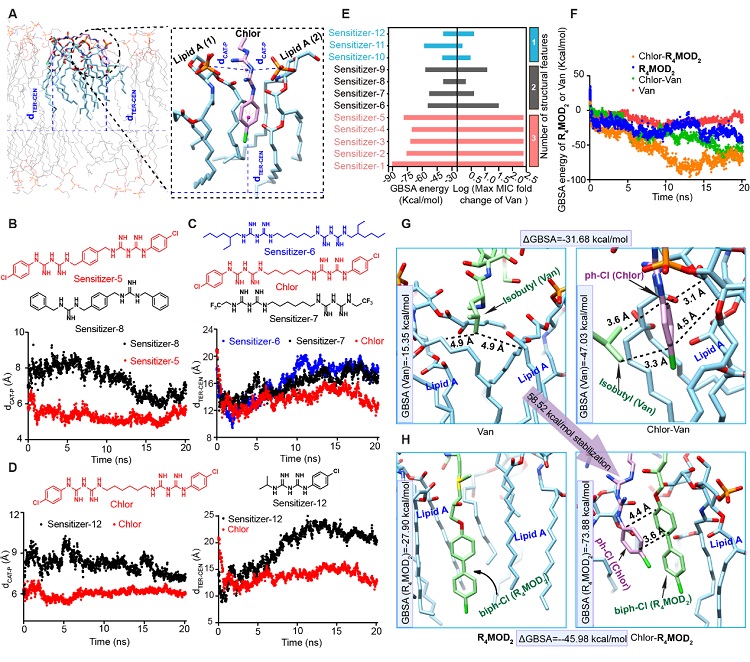
图6. 分子动力学模拟:洗必泰-R4MOD2组合与LPS结合更稳定。
如图7所示,研究团队随后建立了一系列复杂感染模型,结果显示,洗必泰-R4MOD2药物组合最不易产生耐药性,其在菌血共感染,血清共感染,线虫体内感染以及小鼠感染模型中都具有最优的治疗效果,且治疗过程对动物无明显毒性。最后,该团队还在三个额外的组合(erythromycin-洗必泰、lactoferricin-洗必泰以及 vancomycin-Sensitizer-16)上验证“衍生-增敏”策略的普遍性。
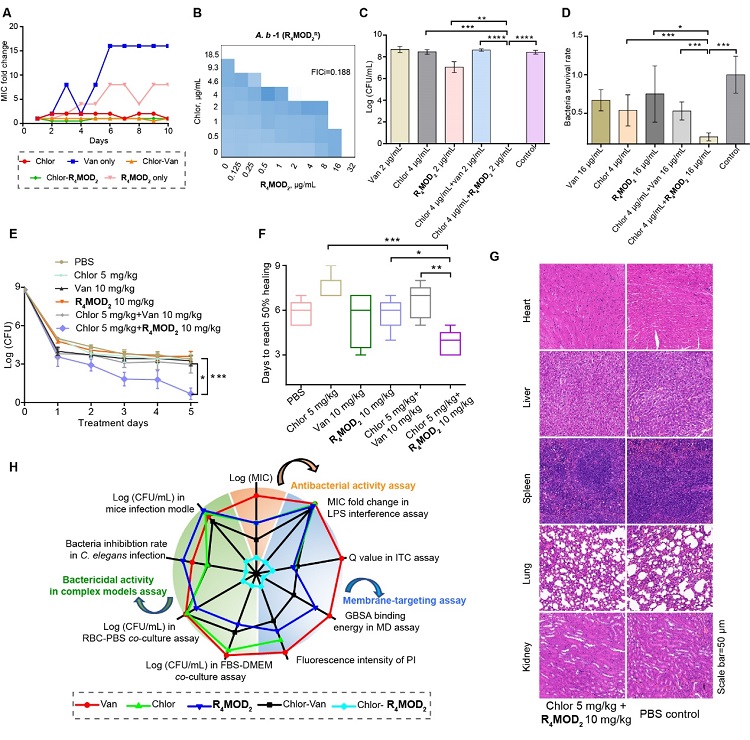
图7. R4MOD2-洗必泰组合在活体动物上展现出优异的抗菌疗效。A-B)洗必泰-R4MOD2组合不易产生耐药性,且对R4MOD2耐药的菌株仍有效。C)菌血共感染模型。D)线虫体内感染模型。E-G)小鼠伤口感染模型H)洗必泰-R4MOD2组合在抗菌活性,复杂模型以及膜靶向方面均表现最好的效果。
总体来说,该研究通过“衍生-增敏”策略赋予抗生素组合额外的膜靶向作用机制,使得整体协同效应远远大于单一的衍生化和增敏的简单相加,从而获得了对革兰氏阴性菌的广谱性杀菌作用,以及并实现了其抗耐药化改造。该成果发表在Journal of the American Chemical Society上,论文第一作者为湖南大学化学化工学院冯欣欣课题组硕士生雷娥,共同一作为中科院上海药物研究所黄蔚课题组硕士生焦尚,华中科技大学物理学院黄胜友课题组博士生陶环宇。通讯作者为湖南大学化学化工学院冯欣欣副教授、中科院上海药物研究所黄蔚研究员和华中科技大学物理学院黄胜友教授。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Potentiation of Vancomycin: Creating Cooperative Membrane Lysis through a “Derivatization-for-Sensitization” Approach
E Lei, Huanyu Tao, Shang Jiao, Anming Yang, Yu Zhou, Min Wang, Kang Wen, Yi Wang, Zhiyong Chen, Xianhui Chen, Junfeng Song, Cailing Zhou, Wei Huang, Lili Xu, Dongliang Guan, Cuiyan Tan, Haoran Liu, Qingyun Cai, Kai Zhou, Justin Modica, Sheng-You Huang*, Wei Huang*, and Xinxin Feng*
J. Am. Chem. Soc., 2022, DOI: 10.1021/jacs.2c03784
冯欣欣课题组简介

前排左二为硕士生雷娥,左三为冯欣欣博士
冯欣欣,湖南大学化学化工学院副教授。2009年于南京大学取得学士学位(导师:宋友老师),2009-2017年在美国伊利诺伊大学(香槟校区)攻读博士学位及进行博士后工作,2017年9月起就职于湖南大学。冯组的主要科研方向为以细菌细胞膜以及DNA为靶标的“抗耐药性”抗菌药物的开发及其化学生物学研究,在相关领域发表SCI论文30余篇,包括Sci. Adv.、JACS、PNAS等。
https://www.x-mol.com/university/faculty/66363
黄蔚课题组简介

黄蔚,中国科学院上海药物研究所研究员、博士生导师、课题组长,兼任国科大杭州高等研究院药物科学与技术学院执行院长。国家高层次人才青年项目 (2012);上海市“浦江人才”学者 (2013);杭州市领军型创新创业团队 (2021);获药明康德生命化学研究奖(2021)、张树政糖科学奖优秀青年奖(2021);中国化学会糖化学专业委员会委员、上海药学会药物化学委员会委员、中国疫苗行业协会糖疫苗专业委员会委员、全国卫生产业企管会转化医学分会常务理事。主要研究方向为糖类药物研发,在糖化学和糖生物学交叉领域,发展新的糖类药物设计技术,在抗体糖工程技术、糖链定点ADC技术、抗耐药菌的糖肽抗生素研发、糖苷类小分子药物研发等项目上,取得了积极的进展。研究成果在Nat. Chem. Biol.、Nat. Protocols、Angew. Chem. Int. Ed.、J. Am. Chem. Soc.、APSB、Cell Dis.、J. Med. Chem.等期刊发表论文90余篇.
https://www.x-mol.com/university/faculty/36597
黄胜友课题组简介

黄胜友,华中科技大学物理学院教授,1998年获武汉大学物理学学士学位,2003年获武汉大学理学博士学位,主要研究方向是结合物理和生物信息学方法研究生物分子间的相互作用及其结构、药物设计以及生物分子的结构-功能关系,相关研究在 PNAS、Nature Communications、Nature Protocols、JACS和 Nucleic Acids Research 等杂志发表论文 100 余篇。所提出分子对接算法和能量打分函数模型在国际蛋白质相互作用CAPRI预测、国际蛋白质结构CASP预测等多类国际权威评测竞赛中多次排名第一。
https://www.x-mol.com/university/faculty/75405
科研思路分析
Q:这项研究最初是什么目的?或者说想法是怎么产生的?
A:我们课题组的整个工作是针对具有“抗耐药性”抗菌药物的开发及其化学生物学研究展开的。细菌耐药性有两个层次的意思:第一层意思是细菌在长期使用的过程中进化出来的耐药性,也成为耐药性突变。第二层意思是阴性菌的固有耐药性,意思是阴性菌具有外膜,很多抗生素无法进入,万古霉素就是这样一个例子。
这个工作针对的是第二种耐药性,也就是阴性菌的耐药性。我们总结了现有的讨论万古霉素在阴性菌上应用的文献,发现无论是增敏或者是衍生的策略,能达到的效果都不佳,未能使万古霉素的抗阴性菌活性达到临床使用所需。我们通过分析这些化合物的活化机制发现,他们的改造缺乏对阴性菌外膜的针对性,从而导致效果受限。我们的DeForSe策略通过增敏佐剂和衍生物结构上膜靶向官能团的相互作用,能够特异性地对阴性菌外膜产生破坏作用,这种强协同带来的破膜使得我们的联合用药有两个显著优势,一是抗阴性菌效果大大增加,二是组合整体具有很强的抗耐药性。因此DeForSe策略可以说为获得更多的广谱、抗耐药抗菌组合提供了一个可行的方案。
Q:DeForSe策略未来的发展前景如何?
A:DeForSe策略的化学本质是联合用药,机制本质是针对细菌多个靶标的多重靶向,在抗菌应用上的优势是强抗菌能力以及低耐药性。从化学上来说,组合用药中两个组分的化学结构变化,即抗生素的衍生化以及增敏佐剂的多样化,能为联合用药提供指数级增长的化学多样性,而这种多样性为获得“长寿命”的抗菌药物奠定了化学基础。目前我们课题组在SymDiCat增敏剂库的开发以及抗生素的定向改造上已经有一定的初步成果,相关动物实验正在开展中,我们期待这些成果能早日推动到临床前及临床研究中。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号