清华大学尹航课题组:可转换型TLR激活/抑制剂为精准免疫调控提供新策略
免疫抑制剂在自身免疫病和抑制器官移植的排斥反应中被广泛应用。然而,免疫抑制剂也会抑制正常的免疫能力,故长期使用或使用不当,可导致严重的不良反应。在临床上被广泛应用并被冠以“药王”之名的免疫抑制剂修美乐(图1)在用药期间也存在着引起免疫力降低、机体易受感染等问题。
图1. 免疫抑制药物修美乐
清华大学药学院尹航教授(点击查看介绍)课题组长期专注于天然免疫受体机制的研究,近日在Nature Communications 上发表论文,报道了他们开发的一种创新性的靶向TLR8的小分子CU-CPD107。通过对该分子作用机制的探索,发现了前所未有能解决诸多免疫抑制剂弊端的新策略。该分子对TLR8小分子激活剂引起的免疫信号具有抑制作用,但是仅在ssRNA等病毒相关分子模式存在时,它又可以转化为一个TLR8激活剂,从而实现了在病灶区精准的激活天然免疫反应。该研究对CU-CPD107双向型的抑制/激活作用分别进行了深入的机制探讨,为抗病毒药物的开发提供了一个新的思路。
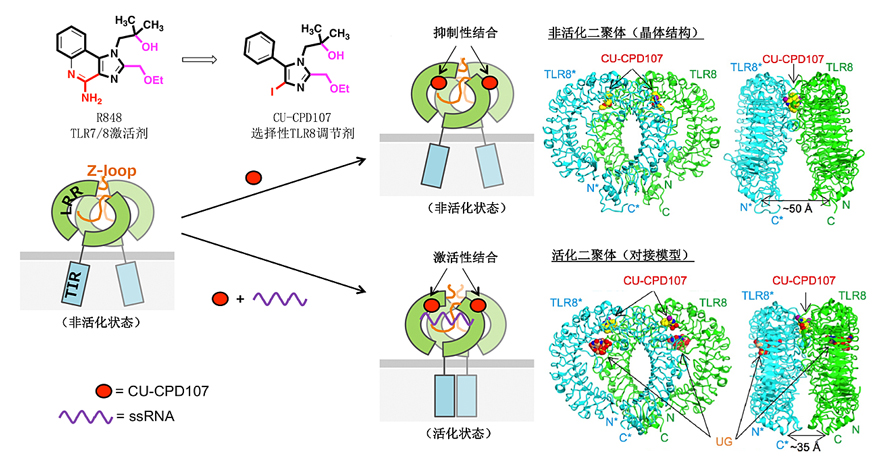
图2. 靶向TLR8的全新小分子CU-CPD107作用机制模式图。
针对当前大流行的新冠病毒,迫切需要新颖的抗病毒治疗方法。TLR8是Toll样受体家族中的一个重要成员,能够识别病毒ssRNA(例如SARS-CoV-2),在抗病毒免疫中扮演着重要角色。然而经典的TLR8调节剂(如R848)会引起非特异性的全身性炎症反应,在临床应用过程中受到了很大的限制,因此需要新的策略更加精准地调节TLR8的活性。该研究从开发特异性的TLR8调节剂为出发点,通过构效关系分析和理性设计得到了一系列新的小分子,这些小分子具有四取代咪唑骨架结构,测试发现它们可以特异性地靶向TLR8。CU-CPD107作为其中的先导化合物,能在HEK Blue hTLRs细胞及人外周血单核细胞(PBMCs)中特异性地抑制R848等TLR8小分子激活剂引起的TLR8信号,而不会干扰其他TLR家族成员信号,并且在浓度高达300 µM时对细胞不具有明显的毒副作用。其中在HEK Blue hTLR8细胞中,CU-CPD107对R848激活的TLR8信号的IC50为13.7 ± 1.1 µM。更有趣的是,在病毒ssRNA存在的情况下,CU-CPD107显示出了意想不到的独特的协同激活活性,能够特异性地增强TLR8信号(图2)。这种同时具有抑制和激活作用的双向性特点通过了分泌型碱性磷酸酶(SEAP)报告信号、RT-qPCR及ELISA等方法得到了证实。结果显示,CU-CPD107可以在不同激活条件下,特异性地增强/抑制TLR8下游细胞因子的mRNA及蛋白的表达水平。
为了进一步地理解CU-CPD107对TLR8的调控方式,该研究也深入探讨了这种激活/抑制的双向性特征机理。首先,尹航教授课题组与东京大学Toshiyuki Shimizu教授合作,解析了TLR8/CU-CPD107的共晶结构。结构显示,CU-CPD107通过将TLR8二聚体锁定在其静息态而阻碍了R848等激活剂与TLR8的结合,从而表现出抑制效果,这种抑制作用在尹航课题组此前的工作中也有报道(Nat. Chem. Biol., 2018, 14, 58–64,点击阅读详细)。其次,通过分子对接、等温量热滴定和定点突变等实验验证,CU-CPD107对TLR8的协同激活作用机制与尿苷类似,即当ssRNA结合于TLR8的主要结合位点时,它可以结合位于TLR8蛋白交界面处的第二结合位点,从而促进两TLR8蛋白单体的结合和活化。值得一提的是,在没有任何其他配体存在的情况下,CU-CPD107并没有表现活性,这解决了过去TLR7和TLR8激动剂作为疫苗佐剂或抗病毒药物时的一个重要弊端。这对任何潜在的抗病毒治疗都是有利的。因为只有受病毒ssRNA侵染的组织组织器官处,才会引起特异性的免疫反应,而健康组织不会受到影响,从而避免不必要的非特异性的全身炎症反应。CU-CPD107的发现为设计新的免疫激活剂和抗病毒药物的开发提供了新思路。

图3. 清华大学药学院尹航课题组近期合影
本研究得到清华大学自主科研春风基金专项(2020Z99CFY036)的支持。自新型冠状病毒爆发以来,尹航课题组与时间赛跑积极开展新冠相关研究工作,从基础科研到应用转化,连续不断地取得了一系列的研究成果。2021年1月2日,课题组在Cell Discovery 报道了题为“SARS-CoV-2 nucleocapsid protein undergoes liquid–liquid phase separation into stress granules through its N-terminal intrinsically disordered region”的研究成果(Cell Discov., 2021, 7, 5),该研究揭示了新冠病毒相分离的分子机制,为靶向宿主细胞内蛋白的药物开发提供了新的靶点和策略。目前虽然已有多种预防新冠的疫苗上市,但是用于新冠治疗的药物研发依然迫切,本研究揭示了抗病毒免疫的新机制,解决了此前免疫调节剂存在的诸多问题,也为先天性免疫反应的精准调控提供了新策略。尹航教授课题组与武汉病毒研究所的邓菲研究员密切合作,开展以天然免疫为基础的新冠病毒创新药物的研发,开发的全新的TLR8小分子调节剂CU-CPD107在活新冠病毒侵染细胞过程中有较强的抗病毒活性,为进一步的抗新冠药物研发打下了基础。此外,还与本领域领先的结构生物学家日本东京大学Toshiyuki Shimizu课题组建立了长期的合作关系,从高通量筛选中得到的先导化合物与特定TLR靶标进行共结晶,同时基于结构的优化与构效关系研究形成互补,进一步地揭示了小分子配体/受体结合的分子机制。近几年的合作成果也在Nature Chemical Biology、Cell Chemical Biology、Journal of Medicinal Chemistry 等诸多期刊发表,揭示了先天性免疫及抗病毒的新机制。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Tetrasubstituted imidazoles as incognito Toll-like receptor 8 a(nta)gonists
Yi Yang, Adam Csaka, Shuangshuang Jiang, Christina Smith, Hiromi Tanji, Jian Huang, Torey Jones, Kentaro Sakaniwa, Lindsey Broadwell, Chengrui Shi, Subada Soti, Umeharu Ohto, Yaohui Fang, Shu Shen, Fei Deng, Toshiyuki Shimizu, Hang Yin
Nat. Commun., 2021, DOI: 10.1038/s41467-021-24536-4
导师介绍
尹航
https://www.x-mol.com/university/faculty/46697
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号