清华尹航团队Nature子刊:牢牢“锁住”TLR8的小分子抑制剂
免疫系统对人体的重要性不言而喻。免疫系统衰弱时,外界病原体比如病毒、致病性细菌或真菌等便有机可乘;与之相对,如果免疫系统过于活跃或活跃得不合时宜,人体则可能发生一些自身免疫性疾病,如红斑狼疮、银屑病、类风湿性关节炎等。控制人体免疫系统的开关是一系列重要的免疫调节受体,其中Toll样受体家族(Toll-like receptors,TLRs)在先天性免疫和适应性免疫中都占据了重要地位。Toll样受体成员众多,人体拥有从TLR1到TLR10共十种Toll样受体。它们各司其职,每时每刻都在甄别进入人体的分子中有没有“坏分子”,比如TLR5专事识别细菌鞭毛中的鞭毛蛋白。
今天小氘要介绍的主角是Toll样受体家族的老八TLR8的抑制剂。TLR8住在细胞内部,它的邻居还有TLR3、TLR7和TLR9。TLR8的特长是识别细菌或病毒的单链RNA。由此很容易想到,对TLR8的调节在抗菌或抗病毒治疗中将有重要作用。另外,研究表明多种关节炎中TLR8也起到了重要的免疫调节功能。不过可惜,TLR8的小分子激活剂已经有不少,特异性的小分子抑制剂却一直没有着落。直到最近,清华大学尹航课题组、东京大学Toshiyuki Shimizu课题组的研究人员报道了第一例TLR8的特异性小分子抑制剂,而且以蛋白-小分子共结晶为基础,对其抑制机理做了详细讨论。文章于11月20号在线发表在Nature Chemical Biology 杂志上。

尹航教授。图片来源:清华大学基础分子科学中心
寻找TLR8的特异性小分子抑制剂并非易事。首先,TLR8在激活或非激活状态下都是两两形成二聚体,两个蛋白质的结合界面非常大,想单靠一个小分子就实现精确地调节,难度可想而知。再者,TLR8处于细胞内,小分子要想作用在上面,需要具有良好的跨膜性和相当的稳定性。此外,由于Toll样受体家族的成员同源性很高,尤其是TLR7和TLR8像孪生兄弟一样,要想实现特异性的调节难度也很大。但为了便于抑制剂应用于化学生物学研究或药物开发,特异性是一个必须满足的指标。
尹航课题组利用高通量筛选方法从14,400分子中找到了4个候选苗头化合物。
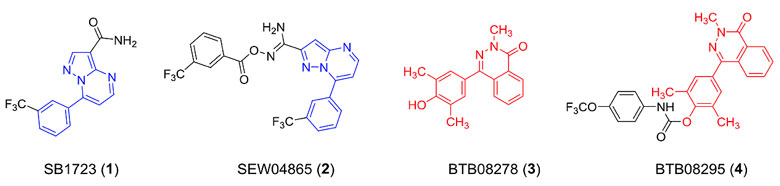
四个苗头化合物。图片来源:Nat. Chem. Bio.
其中化合物1/2、化合物3/4分别共享一个分子骨架。研究人员以第一个骨架为基础,进行了一系列构效关系研究,最终找到了IC50仅为67 nM的化合物CU-CPT8m和IC50仅为6 pM左右的CU-CPT9a、CU-CPT9b分子。CU-CPT8m分子不仅对TLR8有超强的抑制活性,而且对其他TLRs几乎没有任何影响。
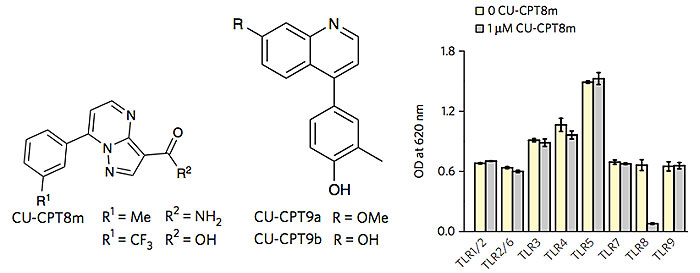
CU-CPT8m、CU-CPT9a、CU-CPT9b的分子结构,以及CU-CPT8m的特异性测试。图片来源:Nat. Chem. Bio.
东京大学的研究人员则成功培养出CU-CPT9b和TLR8的共结晶,以便研究它的抑制机理。同时为了对比,他们还培养了无配体的TLR8晶体和TLR8-R848共结晶(R848是经典的TLR7/8激活剂)。

从左至右分别为TLR8-R848、无配体TLR8、TLR8-CU-CPT9b的晶体图像。图片来源:Nat. Chem. Bio.
从晶体图像可以清楚地看到,在没有配体存在时,两个TLR8形成二聚体,蓝色和绿色区域有相互作用,它们的碳端相距51埃。如果溶液中加入R848,TLR8被激活。R848分别于粉色和绿色区域结合,使二聚体中的TLR8发生平移,碳端距离缩短为34埃。如果溶液中加入CU-CPT9b,它会紧密地与蛋白的蓝色和绿色区域结合,使发生了平移的TLR8重新被拉回到无配体状态,碳端距离也再次变长,回到48埃。就是这么几埃的改变就决定了TLR8被激活还是被抑制。

Toshiyuki Shimizu教授。图片来源:University of Tokyo
研究人员报道的这些抑制剂分子可以看作一把“锁”,牢牢把TLR8二聚体锁住,使其无法发生激活需要的构象改变。这是一种非常新颖的抑制机理。
除了细胞实验和机理研究,研究者还从协和医院收集了骨关节炎患者的滑膜细胞。这些病人的滑膜细胞均有较高程度的炎症反应,而加入CU-CPT8m分子可以有效地降低这些滑膜细胞产生IL-1β、TNF-α等炎症因子的水平。这些结果展现了TLR8抑制剂分子作为抗炎药物的潜力。
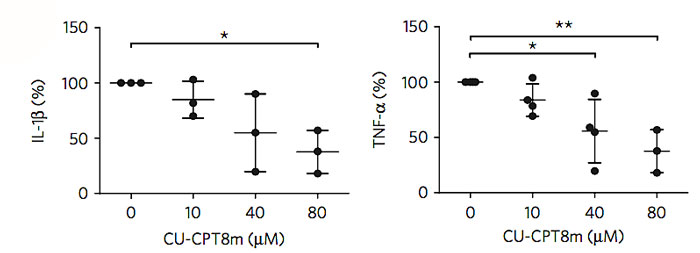
CU-CPT8m分子能够有效地降低病人滑膜细胞的IL-1β、TNF-α水平。图片来源:Nat. Chem. Bio.
这项成果来自中美日三国科研人员的国际合作,共同第一作者包括清华大学张淑婷博士、美国科罗拉多大学博尔德分校Zhenyi Hu和日本东京大学Hiromi Tanji。除了首个TLR8的小分子抑制剂,尹航课题组也曾首次报道了TLR1/2的小分子抑制剂、激活剂,TLR3的小分子抑制剂和TLR5的小分子抑制剂,在该领域处于领先位置。目前尹航课题组在清华大学基础分子科学中心从事免疫调控、细胞外泌体等方面的研究。
免疫调节剂除了应用于传统的抗感染、抗炎等领域,近年来随着癌症免疫疗法的兴起,免疫调节剂作为抗癌药物的“免疫伴侣”颇受追捧。而最近多款治疗银屑病等自身免疫疾病的药物获得FDA批准,让免疫调节剂更受医药市场的广泛关注。希望有更多活性、特异性、成药性俱佳的免疫调节剂诞生,为治疗相关疾病铺平道路。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Small-molecule inhibition of TLR8 through stabilization of its resting state
Nat. Chem. Biol., 2017, DOI: 10.1038/nchembio.2518
参考文献:
Drugging Membrane Protein Interactions, Annu. Rev. Biomed. Eng. 2016, 18, 51-76
(本文由氘氘斋供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号