唐功利团队:HemN家族蛋白C10P和甲基转移酶C10Q双酶体系催化天然产物CC-1065中环丙基结构单元的形成
含有环丙基三元环结构的天然产物一般具有良好的生物活性,并且有着开发成先导药物的潜力。天然产物中环丙基官能团环张力的存在使其化学合成和生物合成都富有极大的挑战性,但由于这类化合物的重要性,环丙基官能团的构筑在化学合成中已经有很多较为成熟的方法,在生物合成中也取得了一些重要的进展。其中,非活化碳-碳双键的环丙基化尽管在化学合成中可以通过多种方法来实现,但是该过程在天然产物的生物合成中却鲜有报道。
以CC-1065和谷田霉素(yatakemycin, YTM)为代表的螺环丙基环己二烯酮类抗肿瘤抗生素(图1)是一类来源于微生物、含有环丙基药效基团的高活性天然产物,其中包括CC-1065、YTM、多卡霉素等。这些化合物能对DNA进行不可逆的烷基化修饰,从而实现杀死细胞的目的(IC50为pM级)。研究表明,这类化合物是靶向治疗中理想的“弹头”分子,例如,由多卡霉素衍生的抗体药物偶联分子SYD985和MDX-1203已进入临床一期,主要用于治疗非霍奇金淋巴瘤和肾细胞癌。
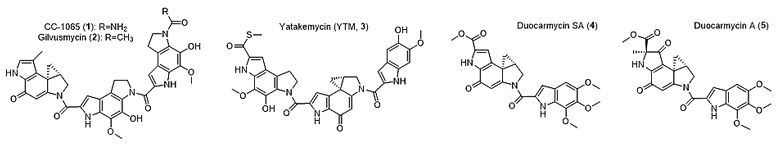
图1. 螺环丙基环己二烯酮类抗肿瘤抗生素
中国科学院上海有机化学研究所生命有机化学国家重点实验室的唐功利研究员(点击查看介绍)团队多年来一直致力于该家族化合物的生物合成研究。在前期的研究中,唐功利团队克隆了YTM(J. Am. Chem. Soc., 2012, 134, 8831)和CC-1065(ACS Chem. Biol., 2017, 12, 1603)的生物合成基因簇,并且发现GyrI-like家族的一个亚家族蛋白具有水解CC-1065和YTM环丙基的特性,这类酶能够赋予微生物对CC-1065和YTM的抗性(Nat. Commun., 2017, 8, 1485)。
最近,唐功利研究团队在该家族天然产物的生物合成研究方面再获突破,该团队在研究CC-1065的生物合成过程中,发现由一个HemN家族自由基S-腺苷甲硫氨酸(SAM)蛋白(C10P)和一个O-甲基转移酶(C10Q)组成的双酶体系共同催化形成CC-1065中的环丙基结构。
该团队在研究CC-1065生物合成途径的过程中,通过系统的体内基因敲除实验发现c10P和c10Q这两个基因的敲除突变株积累同一个环丙基缺失的中间体6,说明这两个基因在CC-1065的环丙基形成过程中都是必须的。他们将C10P和C10Q这两个蛋白表达纯化对中间体6进行体外酶活测试,发现该双酶体系在严格无氧的条件下可以实现该中间体的环丙基化,从而生成CC-1065,同时伴随着甲基化副产物7的生成(图2)。
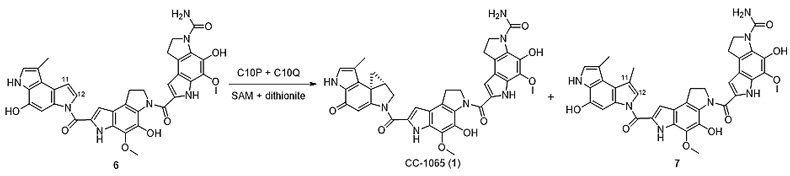
图2. C10P和C10Q共同催化形成CC-1065中环丙基结构单元
为了深入剖析该双酶体系催化CC-1065中环丙基形成的酶的催化机制,该课题组通过对大量酶活反应的富集浓缩,检测到反应体系中存在微量且不稳定的SAM-底物共价交联中间体8,随后的CD3-SAM同位素标记实验结果表明,中间体8的分子量呈现+2,也进一步证实该中间体8是SAM和底物6的共价加合物(图3),这一结果说明该环丙烷化反应很有可能是经历中间体8得到的。
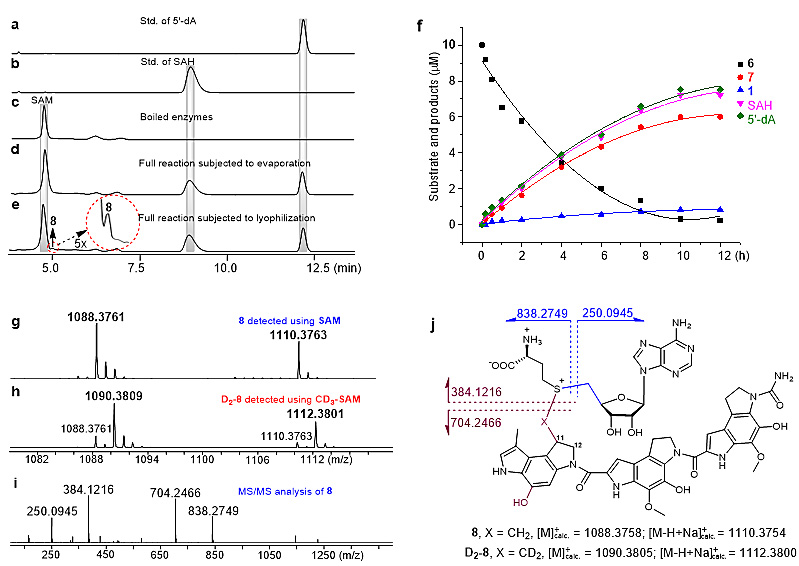
图3. 反应体系各组分的时间梯度曲线和SAM-底物共价中间体8的检测
在CD3-SAM同位素标记实验中,反应生成的环丙烷化产物CC-1065和甲基化产物7的分子量呈现+2(图4),这与中间体8分子量+2的结果一致,由此也进一步证实产物CC-1065和7是经由中间体8形成的;另外,CD3-SAM同位素标记实验中生成的产物5'-dA分子量呈现+1,说明HemN家族自由基SAM蛋白C10P利用第一分子CD3-SAM产生的5'-dA自由基从第二分子的CD3-SAM攫取一个D生成分子量+1的D-5'-dA以及SAM亚甲基自由基(还剩两个D),该SAM亚甲基自由基加成到底物6上,得到分子量+2的中间体8。
基于D2O同位素标记实验,作者发现反应生成的环丙烷化产物CC-1065和甲基化产物7分子量呈现+1,进一步的H2 NMR实验证实,在一部分产物7中D在C12上,而另一部分产物7中D在C11M上,这一结果与SAM亚甲基自由基对底物6发生自由基加成,从而在C12位形成自由基的反应历程一致(图4)。
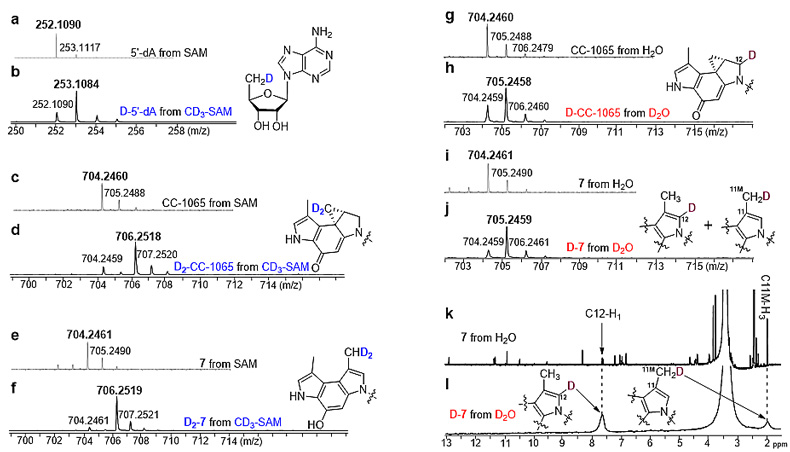
图4. CD3-SAM和D2O同位素标记实验探索环丙烷化反应的机理
作者随后对O-甲基转移酶C10Q中关键氨基酸残基His-138的点突变实验也证明C10Q中第138位的His残基对于催化中间体8到环丙基化产物CC-1065也是必需的。
在这些机理研究结果的基础上,该课题组对C10P和C10Q双酶体系催化CC-1065中环丙基形成的酶催化机理进行了推测(图5):C10P首先利用[4Fe-4S]还原切割第一分子SAM产生5'-dA自由基;这种自由基用来攫取第二分子SAM甲基上的一个氢原子,从而产生SAM亚甲基自由基;接着,SAM亚甲基自由基加成到底物6中一个吡咯环的C=C双键上,得到自由基中间体9,该中间体9从环境中获取一个氢原子生成中间体8;中间体8随后在C10Q的作用下(关键氨基酸残基His-138参与C6位羟基氢的攫取)发生分子内的SN2环丙基化反应生成CC-1065。
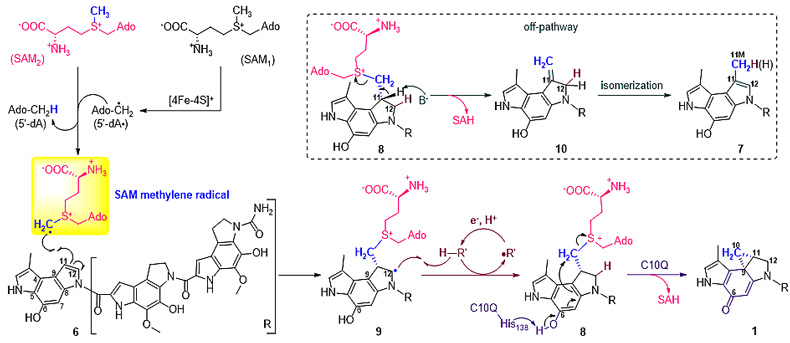
图5. 推测的C10P和C10Q共同催化形成CC-1065中环丙基的酶学机理
唐功利团队揭示了HemN家族蛋白和甲基转移酶组成的双酶体系共同催化完成CC-1065中环丙烷化的机制,不仅能够拓展人们对HemN家族蛋白功能的认知,也帮助人们对甲基转移酶有了新的认识;更预示着生物体内蕴藏着丰富多样的化学反应等待研究者去挖掘。
这一成果近期发表在Nature Communications 上,相关的研究工作主要由唐功利课题组的金文兵博士、吴晟博士(共同第一作者)、袁华副研究员等完成。该工作获得国家自然科学基金委、上海市科委和中国科学院战略性先导科技专项(B类)等经费的大力资助。
该论文作者为:Wen-Bing Jin, Sheng Wu, Xiao-Hong Jian, Hua Yuan & Gong-Li Tang
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A radical S-adenosyl-L-methionine enzyme and a methyltransferase catalyze cyclopropane formation in natural product biosynthesis
Nat. Commun., 2018, 9, 2771, DOI: 10.1038/s41467-018-05217-1
导师介绍
唐功利
http://www.x-mol.com/university/faculty/15570
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号