近红外双发光层级结构纳米载体用于蛋白递送与释放的原位在体监测
蛋白是生命活动的承担着和执行者。利用蛋白的生物学功能,将具有生物活性的蛋白分子传输到特定的病灶部位,目前已成为糖尿病、癌症等重大疾病干预与治疗的重要手段。随着纳米生物医学领域的发展,纳米材料作为蛋白、酶、抗体的输运载体逐渐受到关注,这种策略可以有效保持蛋白生物活性,同时提高细胞摄取效率。长期以来,研究者们在提升纳米载体递送精准度和释放可控性的同时,也同样关心递送过程中蛋白药物何时、何地、如何释放,这对于了解纳米药物的组织摄取、研究药代动力学以及指导精准用药都具有重要的意义。然而,大部分蛋白药物自身不具有光学特性,在递送过程中无法通过生物成像手段进行直接监测。因此,发展一种适用于非荧光生物大分子递送实时监测的通用型策略就显得尤为必要。
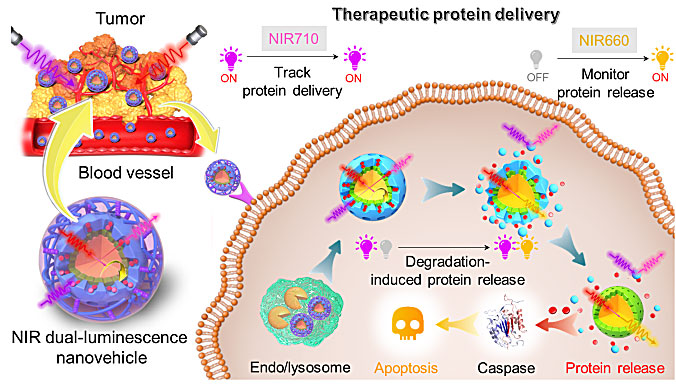
近期,南京大学化学化工学院闵乾昊、朱俊杰研究团队与生命科学学院陈江宁课题组合作,利用红光发射的上转换纳米粒子(UCNPs)与Cy5.5掺杂的可降解介孔硅之间的发光共振能量转移,设计构筑了一种外壳层可降解的近红外双发光层级结构纳米载体,实现了蛋白药物递送与释放的在体监测。在这一设计中,Cy5.5掺杂的可降解介孔硅框架作为蛋白药物的承载容器与UCNPs形成核-壳层级结构。纳米载体通过外层包覆的透明质酸(HA)与肿瘤表面CD44的特异性识别作用进入肿瘤细胞,溶酶体内的透明质酸酶(HAase)降解外层透明质酸包覆层,进而暴露出内层的介孔硅框架。随后,Cy5.5掺杂介孔硅框架的自降解过程同步引发孔内负载蛋白的释放与内核UCNPs上转换发光的恢复,由此可以建立起660 nm处上转化发光强度与蛋白释放量之间的定量关系。该策略通过710 nm处的Cy5.5荧光追踪纳米载体的位置,利用660 nm的上转换发光监测蛋白药物的释放。基于这一核-壳结构近红外双发光纳米载体我们对模式蛋白细胞色素C进行递送,通过对纳米载体实施双通道荧光成像,在细胞、组织、活体水平分别实现了蛋白递送和释放进程的原位监测与追踪。该研究为其他生物大分子递送过程的原位在体监测提供了一种通用型策略。

相关研究成果发表在ACS Nano 上,文章的第一作者是南京大学博士研究生郑芬芬、王晨和硕士研究生蒙甜甜。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Outer-Frame-Degradable Nanovehicles Featuring Near-Infrared Dual Luminescence for in Vivo Tracking of Protein Delivery in Cancer Therapy
Fenfen Zheng, Chen Wang, Tiantian Meng, Yuqian Zhang, Penghui Zhang, Qi Shen, Yuchao Zhang, Junfeng Zhang, Jianxin Li, Qianhao Min*, Jiangning Chen*, Jun-Jie Zhu*
ACS Nano, 2019, 13, 12577-12590, DOI: 10.1021/acsnano.9b03424
导师介绍
闵乾昊
https://www.x-mol.com/university/faculty/63208
朱俊杰
https://www.x-mol.com/university/faculty/11600
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号