四川大学秦勇团队Chem:天然产物集群式合成新突破
近60%的小分子化学药物来源于天然产物及其类似物。结构复杂多样的天然产物作为创新药物的重要来源,在新药发现中起到了重要的作用。天然产物的全合成工作难度高、挑战性强,是有机化学和药物化学的重要研究领域。随着现代有机合成技术和方法学的不断发展,除一些结构极端复杂的天然产物外,人类实现单个或少数几个同一家族天然产物的合成已不再遥不可及。而如何在合成方法学实现进一步突破,快速有效地进行大量天然产物的集群式合成仍然极具挑战性(参考:Burke的化学“登月计划”,Science, 2017, 356, 231)。近日,四川大学华西药学院的秦勇教授团队利用光催化的自由基串联反应,快速制备了多种吲哚生物碱骨架,并进而实现了33个具有重要生理活性的单萜吲哚生物碱的集群式合成。相关研究结果近期发表在Chem 上,该工作主要由四川大学博士生汪小蓓、夏栋梁、周瑞捷、周骁汉和重庆大学博士生秦文芳、周启龙、刘文涛、戴翔、王慧婧等共同完成。
单萜吲哚生物碱结构复杂多样、分布广泛、数量大(超过3000个)、生理活性显著,其中的许多成员如利血平、喜树碱、长春花碱等作为临床药物使用,一直以来是药物化学家和合成化学家的重要研究领域。如图1A所示,单萜吲哚生物碱根据单萜结构部分的骨架差异可分为三种骨架类型,分别为柯楠因型(Corynanthe)、白坚木型(Aspidosperma)和依波加明型(Iboga)。从生源合成上看,所有单萜吲哚生物碱都可以归为由色胺和裂环番木鳖苷经异胡豆苷合酶(Strictosidine synthase)和胡豆葡萄糖苷酶(Strictosidine glucosidase)催化缩合首先得到柯楠因型中间体,再通过该中间体转化为非重排型(蓝色,图1A)和重排型(黑色,图1A)的天然产物。虽然自由基串联反应是一种非常高效的成键方法,但如何有效地控制其高反应性和较差的选择性则是能否利用该反应合成天然产物的关键。本研究中,作者创造性地设计了以简单易得的手性苯胺(如2,图1B)为底物,在碱性条件下去质子化,进一步在光参与的催化条件下氧化成氮自由基,并进攻烯胺β位形成C-N键。所得的酰胺氮的α位碳自由基可进一步发生分子内自由基加成(途径a),得到白坚木型衍生物3,或通过分子间自由基加成(途径b)得到四氢咔波啉衍生物4。若底物中酰胺氮的侧链上含有接受自由基的官能团时(双键或三键),则可发生分子内/分子间/分子内的自由基串联反应生成柯楠因型衍生物5。
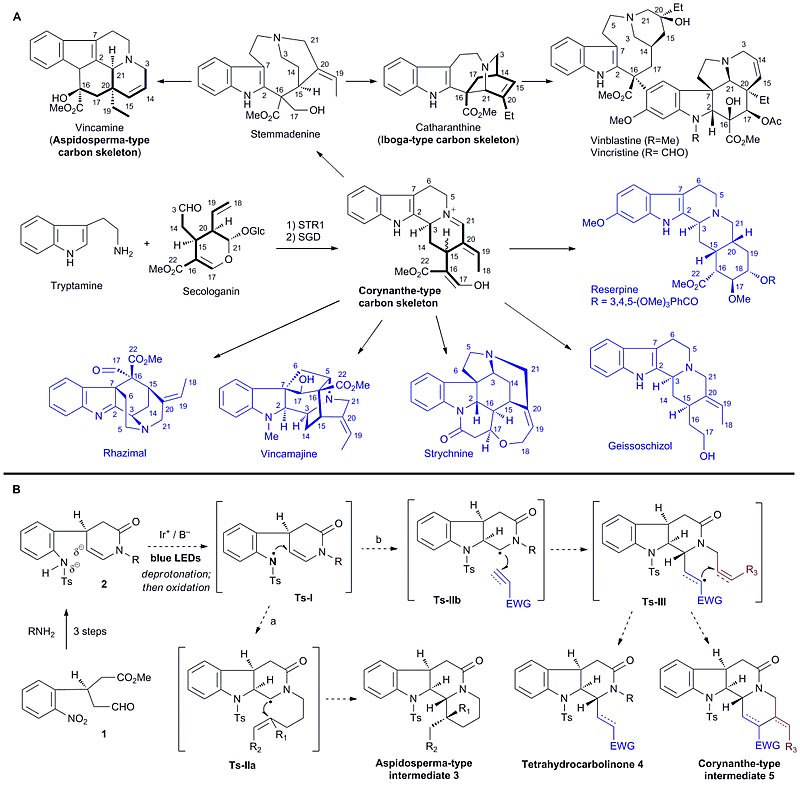
图1. 研究背景与合成设计。图片来源:Chem
经过深入细致的反应条件筛选,作者最终确定以Ts保护的手性苯胺2为底物,Ir(dtbbpy)(ppy)2PF6为光敏剂,KHCO3为碱,在蓝光LED灯的照射下,分别实现了上述三类自由基串联反应。如图2所示,他们首先以底物2a进行分子内/分子内串联尝试确定最佳反应条件,以良好的收率和高非对映选择性得到产物3a。随后他们对反应的底物范围进行了扩展,以中等到良好的收率得到骨架丰富、稠合方式多样的白坚木型衍生物3b–3n。该自由基串联反应对水不敏感,可在四氢呋喃和水的混合溶剂中顺利进行。产物的立体化学均得到了良好的控制,尤其是C2和C3位。此外,多种官能团如酯基、氰基、酮基、醛基等都体现出良好的兼容性。
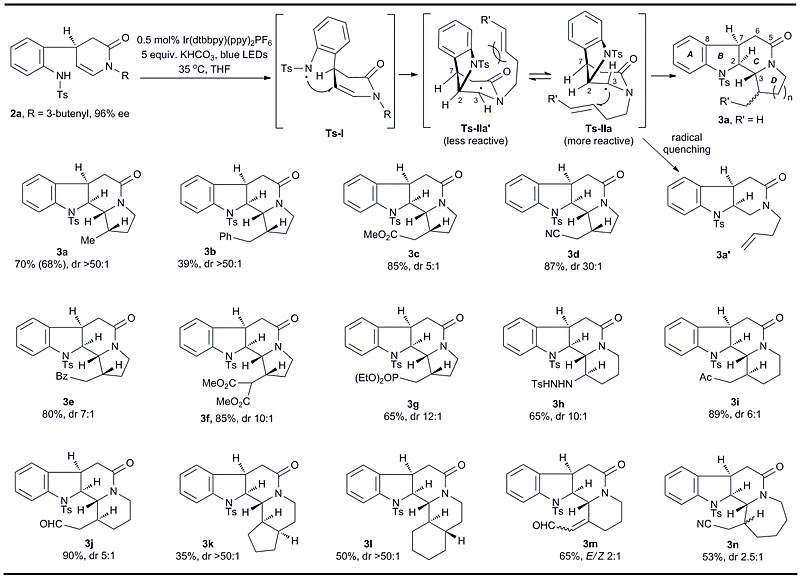
图2. 白坚木型衍生物3的制备。图片来源:Chem
随后,作者发现底物2o和Michael受体6–9在上述最佳条件下,经过分子内/分子间自由基串联反应可生成多种四氢咔波林衍生物4a–4n(图3A)。作者进一步通过底物10a–10g和Michael受体7反应进行分子内/分子间/分子内自由基串联反应,以较好的收率和高非对映选择性得到柯楠因型衍生物5a–5i(图3B)。所有产物的立体化学均得到了良好的控制。该反应同时生成三个新的化学键和两个新的环系结构,不仅立体选择性地构建了柯楠因生物碱骨架,并且在骨架远端引入了各种官能团,如氰基、醛基、酮基和末端双键等,为进一步的官能团化奠定了基础。
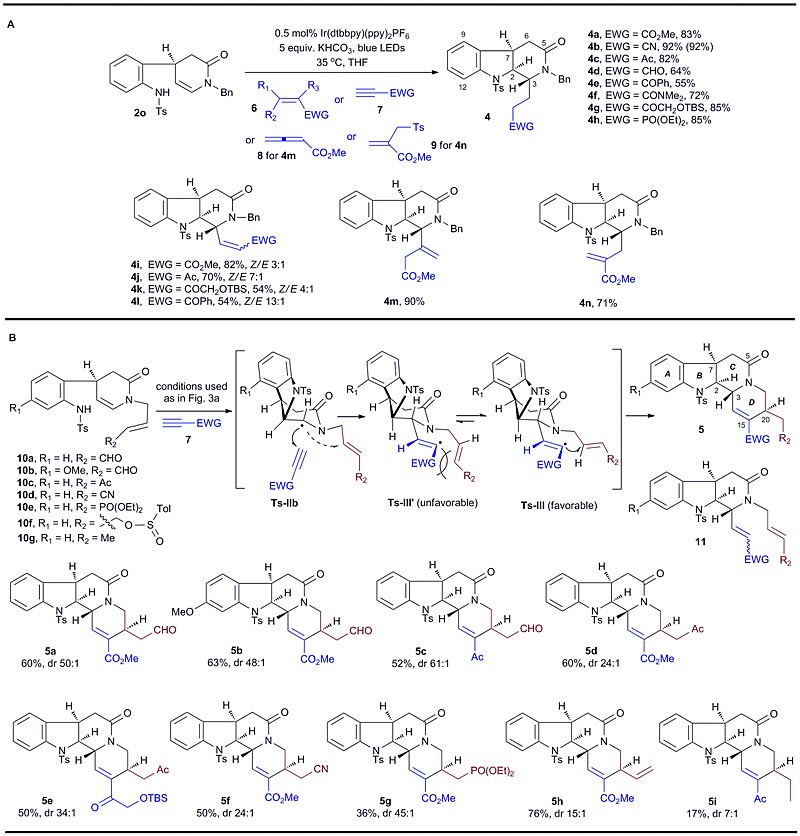
图3. 四氢咔波啉衍生物4和柯南因型衍生物5的制备。图片来源:Chem
基于上述方法学的研究,作者以此为关键反应,成功合成了33个分属于四个不同家族的单萜吲哚生物碱及4个天然产物的非对映异构体。如图4所示,底物2p经分子内/分子内自由基串联反应,可以较高收率成功构建C20位季碳手性中心得到中间体12a和12b。后者经5~9步可分别完成(+)-eburnamenine等6个eburnamine–vincamine家族天然产物的全合成。
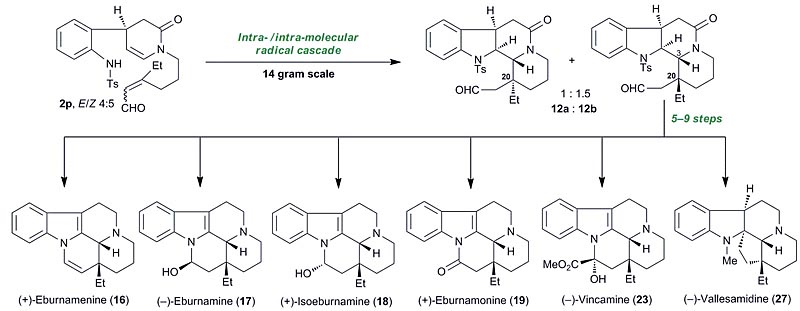
图4. Eburnamine–Vincamine家族生物碱的全合成。图片来源:Chem
底物10c与Michael受体6c发生分子内/分子间/分子内串联反应,经酸处理后一锅法高效发生4个成键反应,新形成3个环系,得到含有育亨宾类单萜吲哚生物碱基本骨架的四个非对映异构体28a、28b、29a和29b。主要异构体29a和29b通过进一步官能团转化,快速合成了(+)-yohimbane等8个育亨宾类生物碱和(–)-yohimbinone等3个天然产物的非对映异构体(图5)。

图5. 育亨宾家族生物碱的全合成。图片来源:Chem
如图6A,化合物10h与Michael受体6i发生分子内/分子间/分子内串联反应,以高收率得到两组混合物51a–51b和51c–51d。利用产物在C15位的立体多样性和末端双键的顺反差异,以51a–51d为原料通过简单的修饰即可高效合成(+)-isogeissoschizol等8个柯南因家族生物碱和1个天然产物的非对映异构体(+)-3-epi-isogeissoschizol。化合物10f与Michael受体6i发生分子内/分子间/分子内串联反应可高效地制备非对映异构体62a–62d(图6B)。以62为原料,他们进一步实现了(+)-corynantheol等另外5个柯南因家族生物碱和(+)-ajmalicine等6个杂育亨宾家族生物碱的全合成。
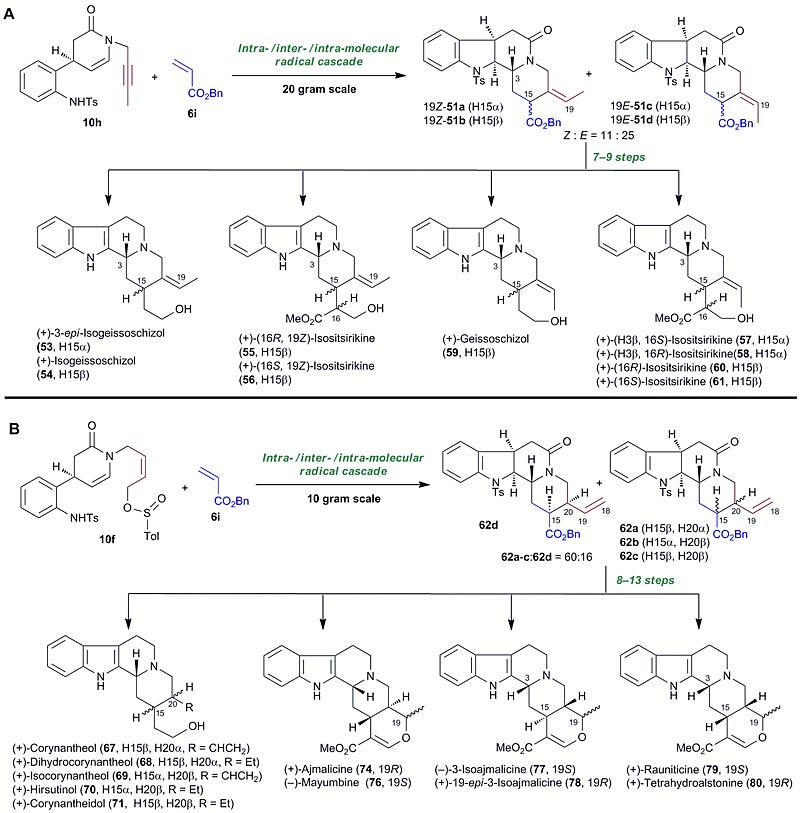
图6. 柯南因和杂育亨宾家族生物碱的全合成。图片来源:Chem
──总结──
秦勇教授团队发展了一种新颖的光氧化还原催化的自由基串联反应。该自由基串联反应操作简便,对水不敏感,可用于规模化合成。他们从简单的原料出发,以该反应为关键步骤,通过6~14步简洁地合成了33个单萜吲哚生物碱,这在过去是很难实现的。
该工作的主要创新性在于:1) 发明了一种无需对氮原子进行衍生化而直接从N-H键官能团化生成氮自由基的方法;2) 巧妙利用氮自由基的缺电子特性,反转了两个原本带负电性的苯胺氮原子和烯胺β碳原子间的反应性,发展了新的手性吲哚啉的合成方法;3) 通过对反应的底物和反应试剂进行合理设计,解决了通常情况下难以控制自由基串联反应中的化学选择性和立体选择性的问题。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A Radical Cascade Enabling Collective Syntheses of Natural Products
Chem, 2017, 2, 803, DOI: 10.1016/j.chempr.2017.04.007
(本稿件来自Chem)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号