手性镍配合物催化α-重氮吡唑酰胺参与的不对称Doyle-Kirmse反应
烯(炔)丙基硫醚与重氮化合物参与的[2,3]-σ重排反应又称为Doyle-Kirmse反应,该类反应可以高效地一步构建含有C-S键的季碳中心,经由烯(炔)丙基硫醚与重氮化合物形成的卡宾中间体得到锍叶立德,继而发生[2,3]-σ重排反应。在不对称Doyle-Kirmse反应的研究中,引发重氮化合物形成卡宾的主要是以下几类金属形成的配合物:Cu(I)、Rh(II)、Co(III)、Fe(II),而Ni(II)配合物催化重氮化合物形成卡宾的报道极为少见。近日,四川大学的冯小明院士(点击查看介绍)课题组报道了镍-手性氮氧配合物催化α-重氮吡唑酰胺参与的不对称Doyle-Kirmse反应。该反应能在温和的条件下高效进行,大多能在10分钟内彻底转化,高收率、高对映选择性地获得重排产物。
通常情况下,手性过渡金属配合物催化的不对称Doyle-Kirmse反应主要有以下两种途径。首先,金属配合物与重氮化合物形成卡宾,随后选择性地与硫的孤对电子作用形成锍叶立德。当叶立德重排过程中有手性催化剂结合时,反应可能会实现有效的不对称烯丙基迁移,否则当手性催化剂释放后,通过信封过渡态的协同机理进行重排依然可以得到锍叶立德手性转移的产物。然而,高对映选择性地实现该反应具有以下难点:(1)手性金属配合物催化剂很难有效区分硫原子的孤对电子对;(2)催化剂结合的叶立德与自由的叶立德存在平衡,而自由的叶立德更容易进行后续的重排反应;(3)当手性锍叶立德消旋的速率远大于重排速率时,反应很难实现较好的立体选择性控制。
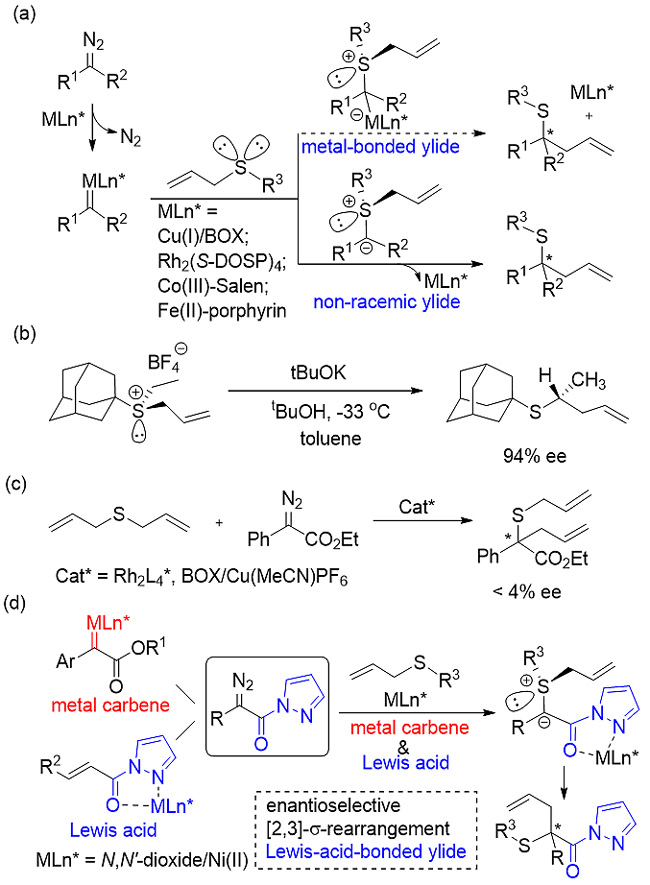
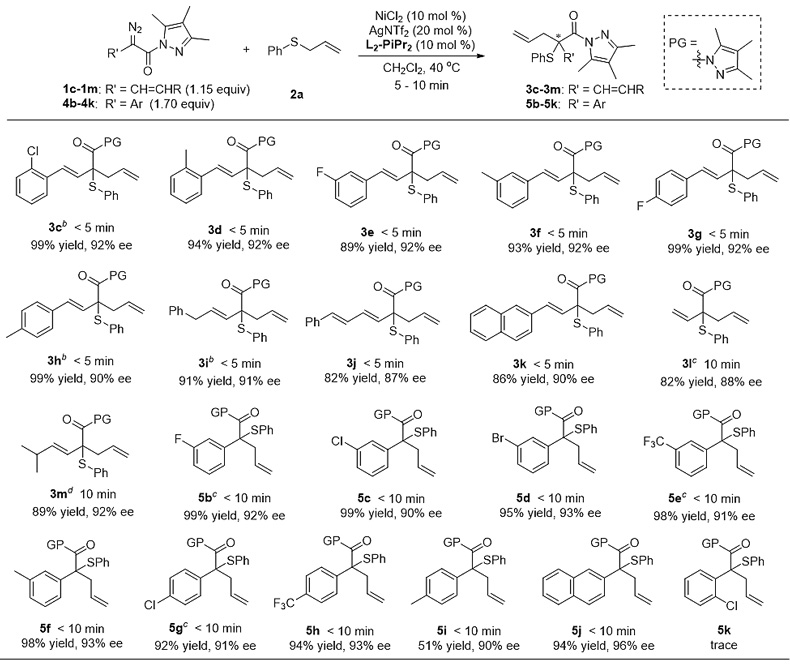
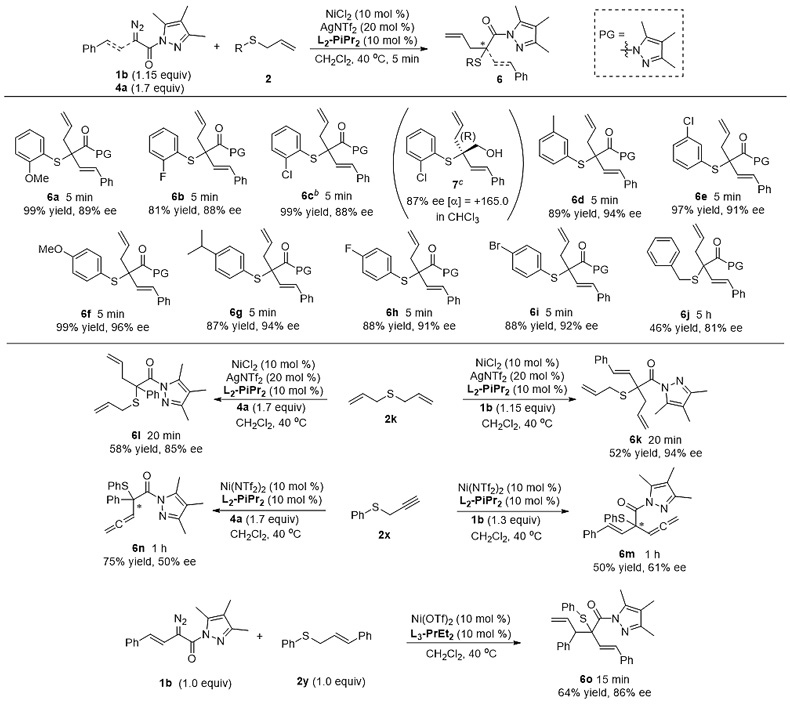
为了解决以上难题,四川大学的冯小明和刘小华团队以重氮酯及吡唑酰胺(J. Org. Chem., 2015, 80, 5704; Chem. Eur. J., 2016, 22, 15119; Chem. Eur. J., 2017, 23, 554)为基础合成了一类重氮吡唑酰胺化合物,在课题组发展的金属氮氧配合物体系下(Acc. Chem. Res., 2011, 44, 574; Org. Chem. Front., 2014, 1, 298; Acc. Chem. Res., 2017, 50, 2621),成功实现了Doyle-Kirmse不对称反应。在该体系中,镍(II)-氮氧配合物既能与α-重氮吡唑酰胺形成卡宾中间体,又能在[2,3]-σ重排过程中与吡唑酰胺发生配位作用,从而利用该双功能策略高效地实现了不对称Doyle-Kirmse反应。
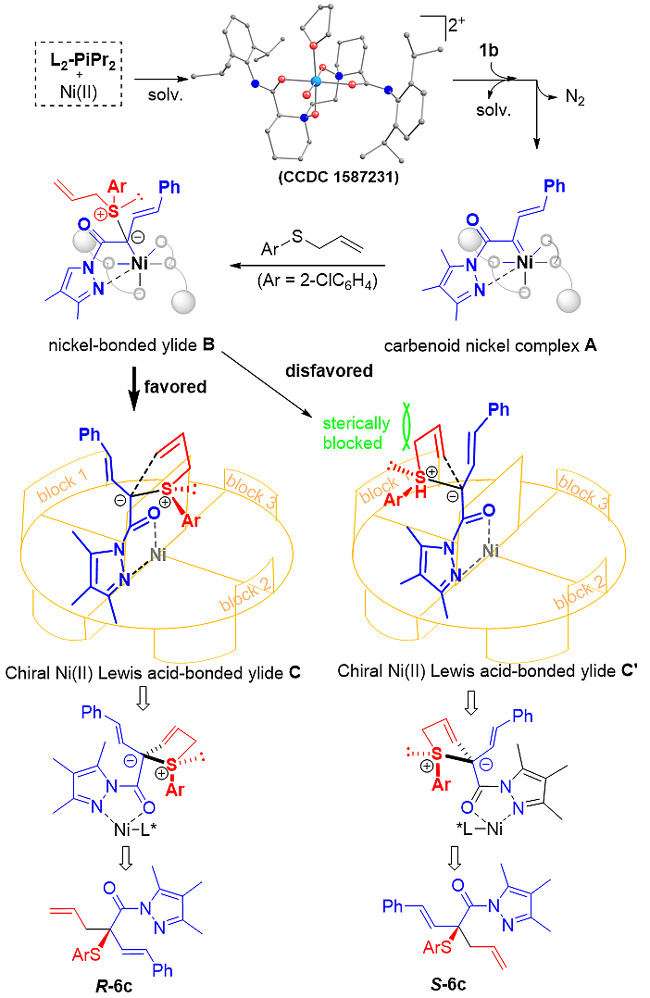
在该类反应中,一系列β-烯基及苯乙酸衍生的α-重氮吡唑酰胺大多在较短的反应时间(5-20分钟)内能取得优异的结果,得到最高99%的收率及96%的对映选择性。后续大量的控制实验也证明,吡唑酰胺的引入能有效促进形成手性Lewis酸催化剂结合的叶立德中间体,从而揭示该反应的真正历程。另外,反应依然可以在短时间内进行克量级规模的实验,得到的最终产物可以在对映选择性基本保持的情况下转化成手性醇、酯及酰胺类化合物,为该反应在天然产物及药物分子的合成中提供应用潜力。同时,作者也根据产物的绝对构型及催化剂的单晶结构,提出了可能的催化循环过程及立体控制模型。
这一成果近期发表在Journal of the American Chemical Society 上,文章的第一作者是四川大学的博士研究生林潇斌。
该论文作者为:Xiaobin Lin, Yu Tang, Wei Yang, Fei Tan, Lili Lin, Xiaohua Liu, Xiaoming Feng
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Chiral Nickel(II) Complex Catalyzed Enantioselective Doyle-Kirmse Reaction of α-Diazo Pyrazoleamides
J. Am. Chem. Soc., 2018, 140, 3299, DOI: 10.1021/jacs.7b12486
导师介绍
冯小明
http://www.x-mol.com/university/faculty/12766
刘小华
http://www.x-mol.com/university/faculty/12781
科研思路分析
Q:这项研究最初是什么目的?或者说想法是怎么产生的?
A:如上所述,不对称Doyle-Kirmse反应一直是有机合成方法学中较难实现的一类反应,而设计合成新的α-重氮吡唑酰胺化合物目的就是在重氮化合物引入可以与手性Lewis酸配合物配位的基团,使得该反应在重排过程中的立体选择性得到控制,从而克服以上提到的困难,实现不对称反应。我们最初的设想是通过经典的过渡金属形成卡宾中间体及锍叶立德中间体,通过双金属接力催化策略实现手性控制,而在真正的反应考察中发现仅在镍-手性氮氧配合物催化下就可以同时达到上述两个目的,从而实现不对称Doyle-Kirmse反应的新突破。
Q:研究过程中遇到哪些挑战?
A:该反应最大的挑战在于重氮底物的合成以及反应机理的探究。如上所述,如何设计底物并实现底物的合成是该反应的一大挑战。在此之前,我们也尝试过各种可能发生配位的重氮化合物的合成,均以失败告终。另外,这类化合物在机理探究方面也遇到较大的挑战。
Q:该研究成果可能有哪些重要的应用?哪些领域的企业或研究机构可能从该成果中获得帮助?
A:该研究成果完成了不对称[2,3]σ-重排反应的重大突破,引入的吡唑酰胺易于转化,为构建含有C-S键手性季碳中心的天然产物或药物分子提供了有效的途径。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号