三组分的有机金属酪氨酸生物偶联反应
蛋白质生物偶联反应能够形成具有独特结构和反应性的合成生物分子,在生物药物开发、生物材料合成、化学生物学和生物物理学的研究中得到广泛的应用。该类反应具有反应多样性、正交性等优势,因而吸引许多研究者致力于探索更多新的反应。目前为止,化学家们已经发展了许多重要的选择性修饰氨基酸的方法,由此为分子中引入非天然氨基酸提供了有效的途径。然而,这些生物偶联反应主要集中于研究有机连接体和有机官能团的修饰,并涉及过渡金属催化及介导的过程。无机和有机金属配合物的引入为发展新的反应带来了便利,也为光学成像、光物理学及化学提供了新的机遇。
近日,美国莱斯大学(Rice University)化学系的Zachary Ball(点击查看介绍)课题组在Angew. Chem. Int. Ed. 上发表文章,报道了Rh(III)盐参与的有机金属生物偶联反应:酪氨酸残基发生金属化形成Rh(III)/酪氨酸配合物,并同时与硼酸试剂转金属化引入官能化的芳基片段,该复合物又可以在强还原剂二硫苏糖醇(DTT)作用下分解为氨基酸残基。他们利用这种方法实现了多肽和蛋白质在水溶液介质中温和的生物偶联,同时还可引入其他重要的官能团,如亲和基团或荧光基团。基于无机连接体的亚稳定性,偶联产物仅在亲核性的氧化还原物种存在时才会被切断,对典型的生物环境较为稳定。这篇文章也被评为当期的VIP文章。
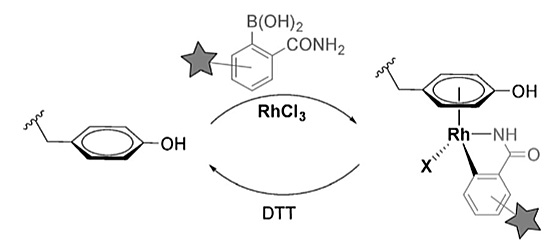
图1. Rh(III)盐、硼酸和氨基酸残基参与的三组分反应以及DTT参与的选择性分解反应。图片来源:Angew. Chem. Int. Ed.
以往的工作报道了铜(II)催化剂可以通过Cran-Lam过程催化N-H键的芳基化和烯基化。作者首先考察了不同过渡金属盐对硼酸转化的反应活性,以炔烃官能化的芳基硼酸对酪氨酸残基进行修饰,使用“化学”蛋白质印迹分析的方法确定引入硼酸基团的效果。仅有两种金属盐能参与配位炔烃标记的蛋白质:一种是先前报道的铜(II)盐参与的反应,另一种涉及Rh(III)参与的过程,简单的RhCl3盐便可作为最佳的金属促进剂。作者随后通过小分子肽设计的实验确定了酪氨酸残基是成功实现修饰过程的充要条件。他们以RhCl3对四种小分子肽进行修饰,以Na2CO3溶液作为缓冲体系,在37 ℃的反应温度下反应18 h,邻位含有酰胺基且间位含有三氟甲基的苯硼酸2表现出比邻硝基苯硼酸1更好的反应活性。由于H-RPPGFSPFR-OH与H-RPKPQQWFWLL-NH2中没有酪氨酸残基,小分子肽未表现出明显的反应活性。他们还利用质谱分析考察生成产物的比例,以分子离子峰及碎片峰的信息确定了酪氨酸残基是有机金属修饰的位点。
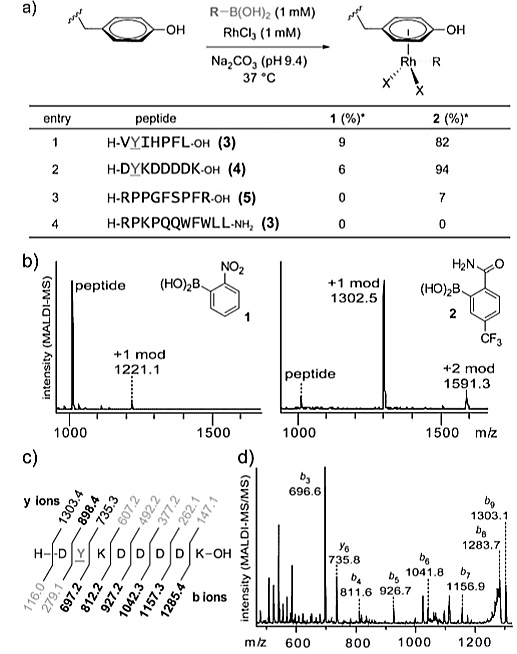
图2. RhCl3作用下小分子肽与硼酸的反应。图片来源:Angew. Chem. Int. Ed.
随后作者在标准条件下,以小分子肽3和7为模板底物,对不同硼试剂进行了考察,当硼酸换作硼酸酯时反应不能发生,说明硼酸基团对反应具有关键的作用。除了苯硼酸,烯基硼酸也具有反应活性(entry 4)。苯硼酸邻位含有酰胺基时具有优秀的反应活性,当酰胺基换作羧基或者N-甲基酰胺时(entry 9和10)反应同样不能发生。
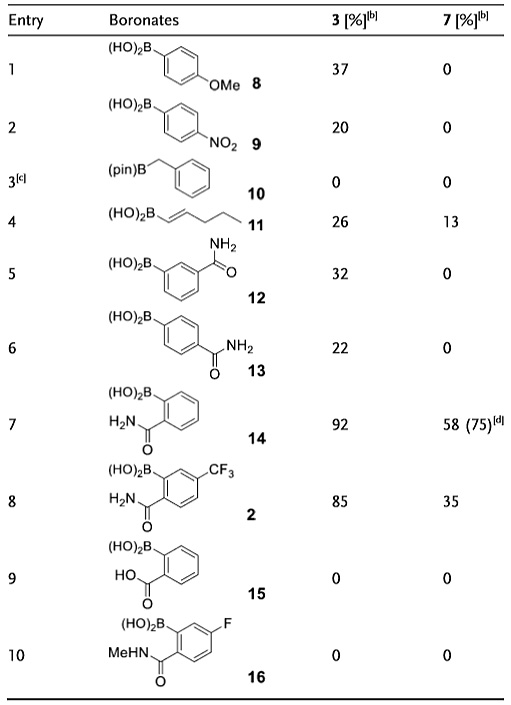
图3. 硼试剂的筛选。图片来源:Angew. Chem. Int. Ed.
在优化的反应条件下,作者尝试了多种肽类底物与RhCl3盐的配位情况,6种小分子肽和硼试剂2或者14反应都得到了良好到优秀的产率,即使在具有Lewis碱性的侧链(Lys、His、Met)及其他敏感侧链(Phe、Trp)存在的情况下,反应也能有效地进行。
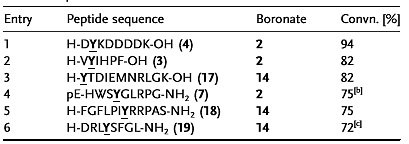
图4. 小分子肽底物的适用性考察。图片来源:Angew. Chem. Int. Ed.
除了小分子肽底物外,这种有机金属生物偶联反应还可用于蛋白质底物。胰凝乳蛋白酶原A(Chymotrypsinogen A)含有四种不同程度暴露于溶剂中的酪氨酸残基。他们制备了脱硫生物素修饰的苯硼酸(20a)进行生物偶联。以单脱硫生物素修饰的溶菌酶作为内标,利用蛋白质印迹分析胰凝乳蛋白酶原与20a的修饰反应,印迹膜上的化学发光显示修饰的胰凝乳蛋白酶原平均含有约1.8个脱硫生物素结构。他们还通过MALDI-MS分析证实了修饰的蛋白质存在,在没有铑盐参与的情况下,修饰的蛋白质未呈现强化学发光,从而证实了铑盐存在的重要性。除了胰凝乳蛋白酶原之外,作者还尝试了肌球蛋白、卵清蛋白、核糖核酸酶(RNase)、牛血清白蛋白(BSA)、赫赛汀等与发荧光的硼酸20b反应。为了评估修饰反应对蛋白质功能的影响,他们将抗HER2单克隆抗体Herceptin与铑盐和20b偶联,并暴露于HER2过表达的癌细胞系(SKBR3),在细胞表面观察到4-硝基苯并恶二唑(NBD)基团发出的荧光,而在20b不存在时不发光,由此证实了单克隆抗体的配合对天然抗原的结合功能没有显著影响。
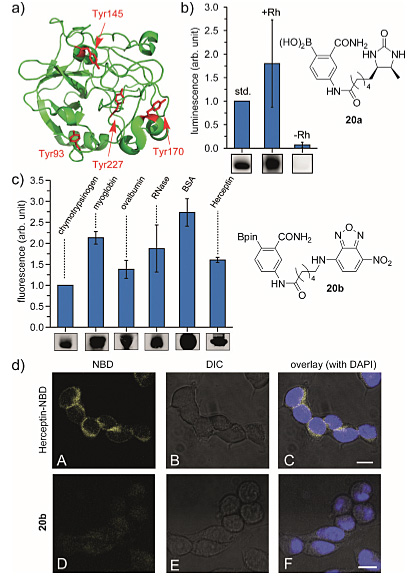
图5. 蛋白质和硼酸的生物偶联。图片来源:Angew. Chem. Int. Ed.
最后,作者还考察了多肽和蛋白质-铑配合物的稳定性,将几种具有重要生物学意义以及可能影响过渡金属配位过程的试剂(谷胱甘肽、二硫苏糖醇、过氧化氢等)加入铑-脱硫生物素修饰(rhodium-desthiobiotin)的卵清蛋白中,除了二硫苏糖醇和过氧化氢外,修饰结构对大部分体系具有良好的稳定性。在二硫苏糖醇和过氧化氢存在的情况下,作者观察到生物素标记显著减少。作者还分别探究了修饰肽的相似二硫苏糖醇敏感性,利用MS分析来评估修饰连接体的稳定性。类似于蛋白质样品的评估结果,修饰的肽3在使用各种其他试剂(菲啰啉、二硫苏糖醇、TCEP、EDTA)处理时都较为稳定。
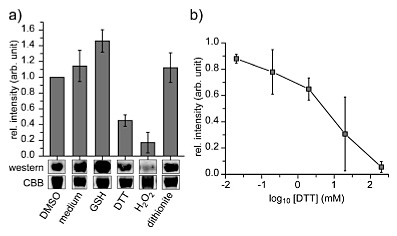
图6. 修饰连接体的稳定性测试。图片来源:Angew. Chem. Int. Ed.
总结
Zachary Ball教授课题组报道了硼酸、RhCl3盐与肽或者蛋白质在酪氨酸残基发生的三组分生物偶联反应,提供了一种新型的合成有机金属生物加合物的通用方法,实现了天然生物分子侧链和过渡金属之间的紧密连接。产物铑金属肽和铑金属蛋白对多种生物相关的试剂表现出高稳定性,只有在亲核性的氧化还原物种二硫苏糖醇和过氧化氢存在的情况下才会选择性断裂有机金属键,从而为可控和无痕释放提供机遇,具有重要的生物学意义。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A Three‐Component Organometallic Tyrosine Bioconjugation
Angew. Chem. Int. Ed., 2018, 57, 2827, DOI: 10.1002/anie.201711868
导师介绍
Zachary Ball
http://www.x-mol.com/university/faculty/1512
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号