福州大学杨黄浩/李婧影教授团队JACS:化学创新驱动mRNA疫苗高效递送,开启剂量节约新纪元
信使RNA(mRNA)疫苗在新冠疫情中发挥了关键作用,挽救了无数生命,成为mRNA治疗领域的重要里程碑。目前,脂质纳米颗粒(LNP)作为临床上最先进的化学合成载体,在保护长单链、带负电的mRNA中发挥着“运输载体”的作用。然而,传统LNP面临着一个关键挑战——“内体俘获”,仅有1-2%的mRNA能够成功从内体逃逸进入细胞质,导致疫苗效果显著降低、剂量依赖性副作用增加、原材料需求上升以及生产成本提高。因此,提高mRNA-LNP的递送效率、增强内体逃逸能力以减少所需剂量,已成为当前mRNA疫苗技术亟待解决的关键问题。
为解决这一瓶颈,福州大学化学学院杨黄浩/李婧影教授团队创新性地开发了一种基于二硫戊环化学修饰的脂质纳米颗粒(SLNP),通过独特的硫醇介导细胞摄取机制,成功突破了传统mRNA递送系统面临的“内体俘获”瓶颈,实现了mRNA向细胞质的高效直接转运,为开发新一代高效且剂量节约型的mRNA疫苗提供了全新策略。该成果发表于Journal of the American Chemical Society。杨黄浩教授和李婧影教授为共同通讯作者,博士生连志杰为第一作者。
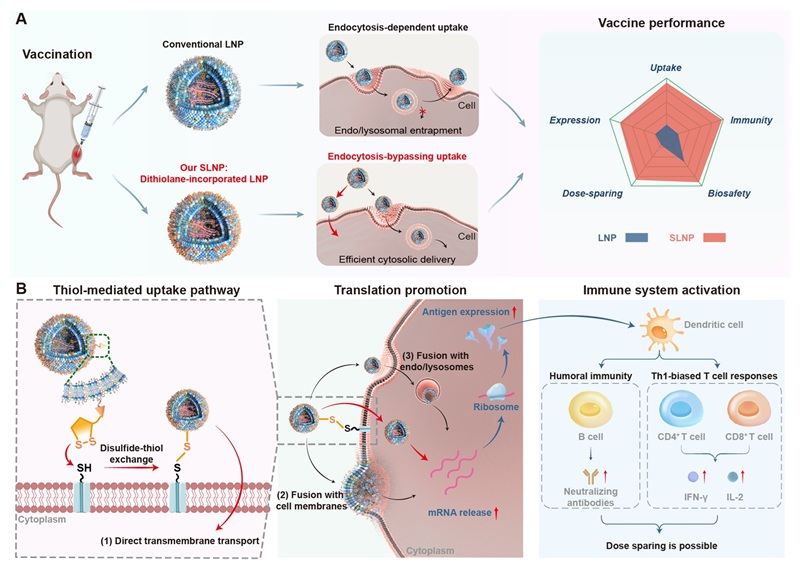
图1. SLNP-mRNA疫苗递送和免疫激活机制示意图
在该项目中,研究团队妙地设计并合成了含有二硫戊环结构的创新型脂质分子(S-DOPE),并将其成功掺入到经典的LNP配方中,构建出新型载体SLNP。通过先进的微流控技术制备的SLNP,表现出均一的粒径分布、卓越的稳定性和极高的mRNA封装效率。这项研究的核心创新在于SLNP所利用的硫醇介导细胞摄取机制。当SLNP与细胞膜接触时,其表面的二硫戊环能与细胞膜上丰富的硫醇基团发生动态共价二硫-硫醇交换反应。这种独特的化学相互作用使得SLNP能够绕过传统的、能量依赖的内吞途径,实现mRNA的直接跨膜转运或更高效的内体逃逸,从而将mRNA直接递送至细胞质,有效避免了内体中的降解。
在细胞实验中,优化S-DOPE含量后的SLNP载体递送mRNA的蛋白表达效率最高可达传统LNP的11倍。值得一提的是,将S-DOPE应用于已上市的Moderna和BioNTech LNP配方中,均能显著提高其mRNA转染效率,这表明二硫戊环掺杂策略对于提升不同类型LNP的递送效率具有普适性和广阔应用前景。
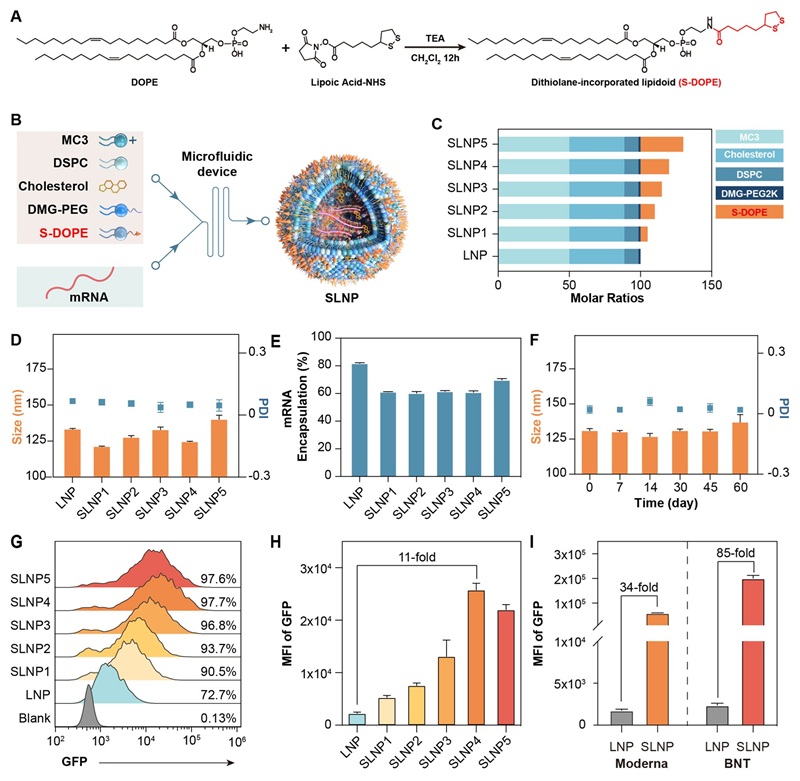
图2. SLNP的设计、表征及其体外mRNA递送能力
为深入探讨SLNP递送效率提高的机制,研究人员利用Cy5标记的mRNA跟踪其在细胞中的摄取和分布。实验结果表明,SLNP可显著提高mRNA的细胞内摄取量,并减少其与溶酶体的共定位,这提示SLNP可有效绕过“内体俘获”。进一步通过内吞途径抑制剂实验证实,SLNP的主要入胞方式为硫醇介导的摄取,而传统LNP则主要依赖于经典的内吞途径。此外,SLNP与模拟细胞膜的脂质体融合能力也明显增强。综上所述,SLNP正是通过细胞膜表面的硫醇与纳米颗粒表面二硫键的动态交换作用,成功实现了更高效的细胞膜穿透和内体逃逸。
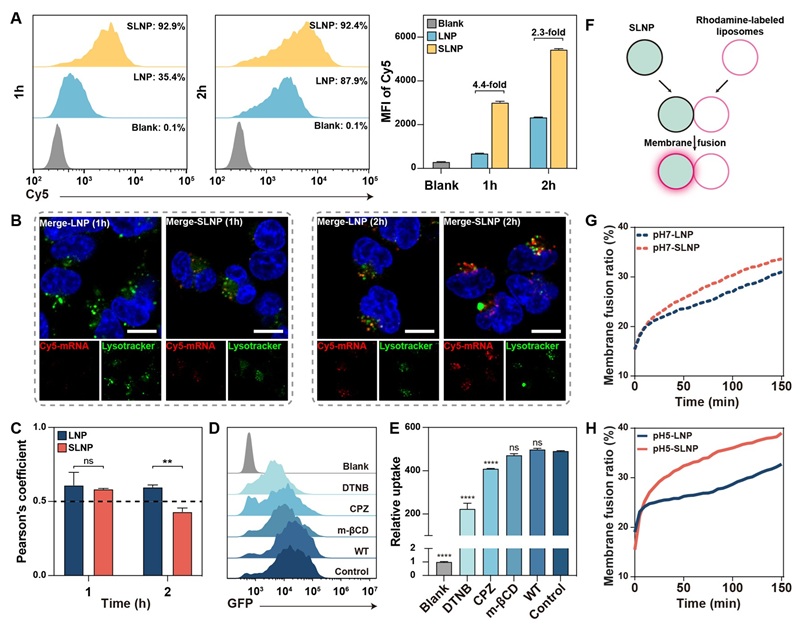
图3. SLNP的细胞摄取机制
为评估SLNP载体在体内的应用前景,研究者分别使用SLNP和传统LNP封装荧光素酶mRNA进行小鼠肌肉注射。在小鼠体内实验中,SLNP组小鼠肌肉注射部位的蛋白表达水平较传统LNP提高4.5倍,证实了SLNP在体内递送mRNA的卓越效率。以新冠病毒刺突蛋白mRNA作为模型抗原进行免疫接种,结果显示,仅需低剂量(0.5 µg)SLNP疫苗即可诱导产生高水平的病毒特异性中和抗体,其滴度与传统LNP疫苗高出20倍剂量(10 µg)时所达到的水平相当。这一发现展示了SLNP显著的剂量节省优势,有望大幅降低疫苗生产和使用成本。
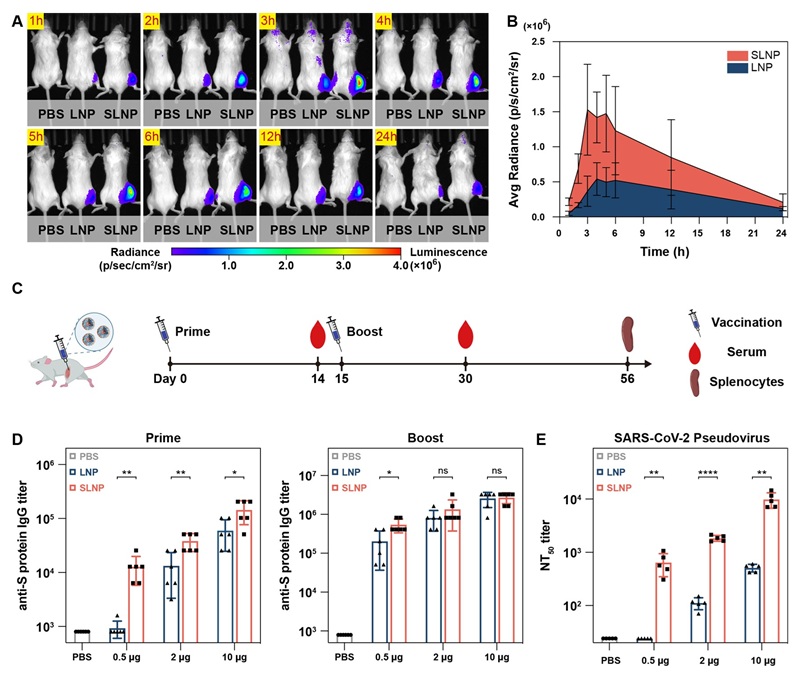
图4. SLNP的体内表达效率及体液免疫应答
除体液免疫外,SLNP疫苗还显著诱导了以干扰素-γ(IFN-γ)和白介素-2(IL-2)为代表的Th1型细胞因子表达,表现出明显的Th1免疫偏向,这对于有效的抗病毒免疫和长期保护至关重要。
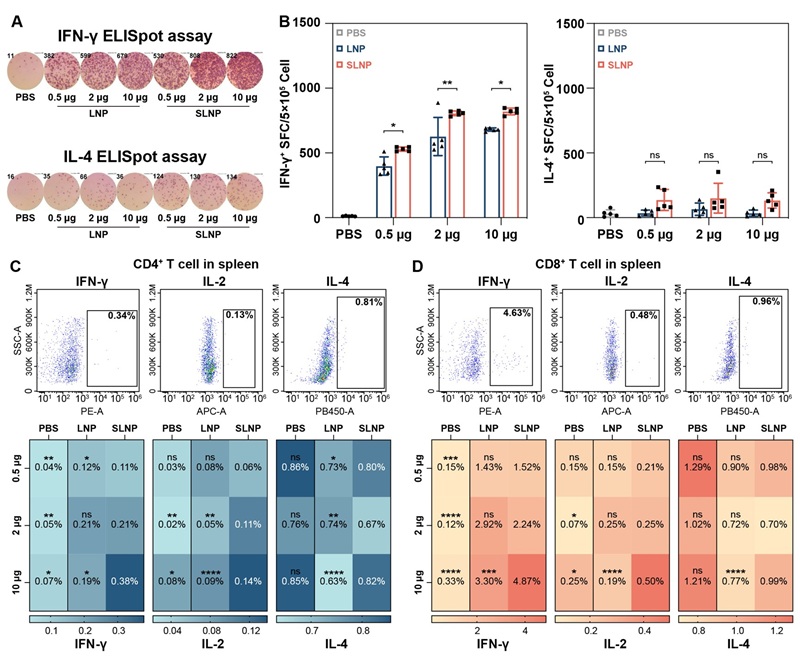
图5. SARS-CoV-2-mRNA-SLNP 疫苗接种引发的细胞免疫反应
急性安全性测试结果显示,注射SLNP疫苗的小鼠主要脏器未出现明显的组织损伤或炎症反应,血液生化指标也处于正常范围。即使是单独注射空载SLNP(无mRNA)也未发现明显的毒副作用。这些综合实验结果表明,SLNP在增强免疫效果的同时保持了良好的生物安全性,有利于后续的临床转化研究。
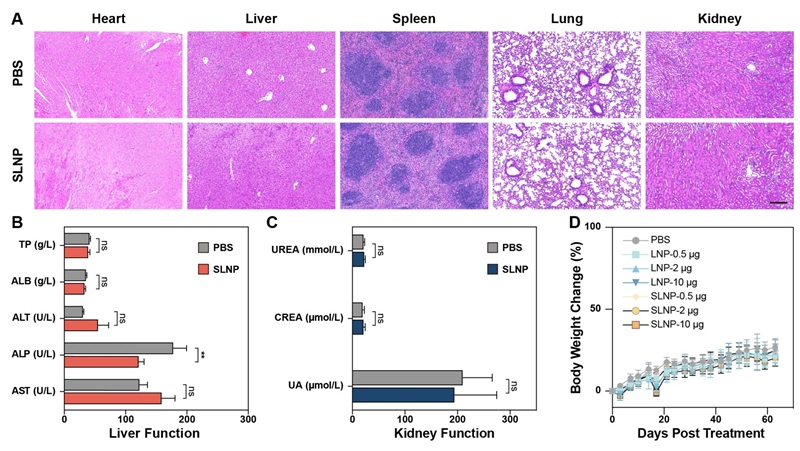
图6. SLNP在C57BL/6J小鼠中的安全性评价
结论与展望
该研究针对mRNA疫苗递送效率低下的核心问题——“内体俘获”,提出了一种突破性的化学设计策略,成功构建出新型硫醇介导摄取脂质纳米载体(SLNP)。SLNP的高效递送能力、显著的剂量节约优势以及良好的生物安全性,使其在mRNA疫苗领域展现出巨大的临床转化潜力。未来,SLNP策略不仅有望解决疫苗剂量节省及供应紧张问题,还有望作为普适性平台,广泛应用于肿瘤疫苗、基因治疗及基因编辑等领域,推动新一代mRNA药物递送技术的快速发展。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Breaking Endosomal Barriers: Thiol-Mediated Uptake Lipid Nanoparticles for Efficient mRNA Vaccine Delivery
Zhijie Lian, Lingying Zheng, Shuya Liu, Junjie Zhang, Jie Zhou, Junjun Wu, Songying Ouyang, Jingying Li*, Huanghao Yang*
J. Am. Chem. Soc. 2025, DOI: 10.1021/jacs.5c05367
导师介绍
杨黄浩
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
























































 京公网安备 11010802027423号
京公网安备 11010802027423号