铱催化Z-选择性不对称烯丙基取代反应
含有Z-烯烃片段的手性分子广泛存在于天然产物中,开发高效的构筑手性Z-烯烃片段方法显得尤为重要,中国科学院上海有机化学研究所游书力研究员(点击查看介绍)团队最近实现了基于Z/E烯烃动力学拆分的铱催化Z-选择性不对称烯丙基取代反应,可以高效合成手性Z-烯烃分子。
过渡金属催化不对称烯丙基取代反应在过去半个世纪中取得了长足的发展,可以在烯丙位及高烯丙位上高效、高对映选择性地构筑碳-碳键或碳-杂原子键。根据底物和产物的几何特征,可将金属催化的不对称烯丙基取代反应分为四类。最常见的途径是由E-或Z-烯烃底物生成手性E-烯烃产物。自2021年以来,游书力研究员团队发展了一类Z-保留不对称烯丙基取代反应,可从Z-烯烃底物出发合成手性Z-烯烃分子。然而从容易获得的E-烯烃原料生成手性Z-烯烃产物无疑是更加高效的一种途径,但是到目前为止未见报道。
最近,Arnold和Hartwig等人发现Z-和E-烯烃和反式烯烃在酶催化反应体系中存在活性差异。受这些进展的启发,研究人员设想能否在铱催化不对称烯丙基取代反应中观察到类似的速率差异。当Z-烯烃底物的反应速率明显大于E-烯烃底物时(kZ > kE),即可从Z/E烯烃混合物出发,通过Z/E动力学拆分策略实现Z-选择性不对称烯丙基取代反应。此外,E-烯烃在适合的光敏剂存在下能发生光诱导E/Z异构化过程,得到Z/E烯烃混合物。因此,将光诱导的E/Z异构化与Z/E动力学拆分过程相结合,就能由E-烯烃原料出发高效合成手性Z-烯烃分子。
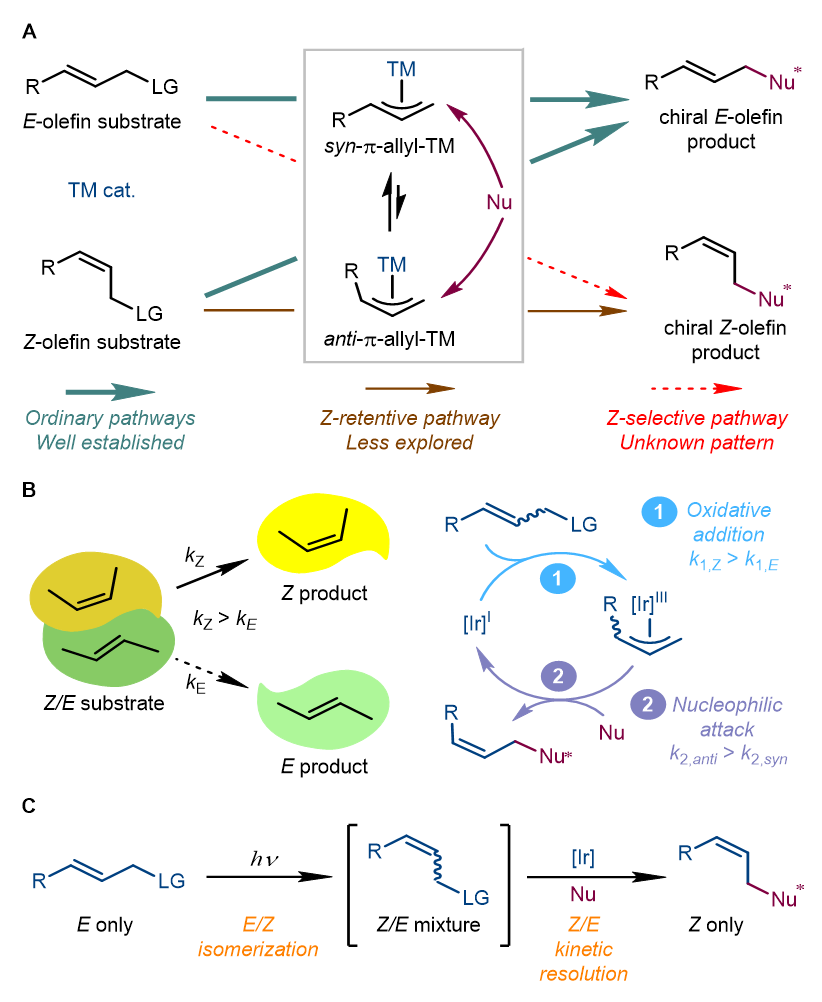
图1. 烯丙基取代反应和Z-选择性不对称烯丙基取代反应设计
基于以上设想,研究人员对反应进行了初步尝试。以Z/E混合的烯丙基前体(1:1)为原料、3-取代氧化吲哚为亲核试剂,在手性磷/烯烃配体衍生的铱催化体系存在下,能以优秀的区域和对映选择性控制得到目标烯丙基取代产物(高达>19/1 Z/E,94% ee)。除氧化吲哚衍生物之外,该反应兼容一系列其他亲核试剂,如芳基胺、丙二酸酯、苯硫酚和苯酚等,以优秀的Z/E选择性得到目标化合物。
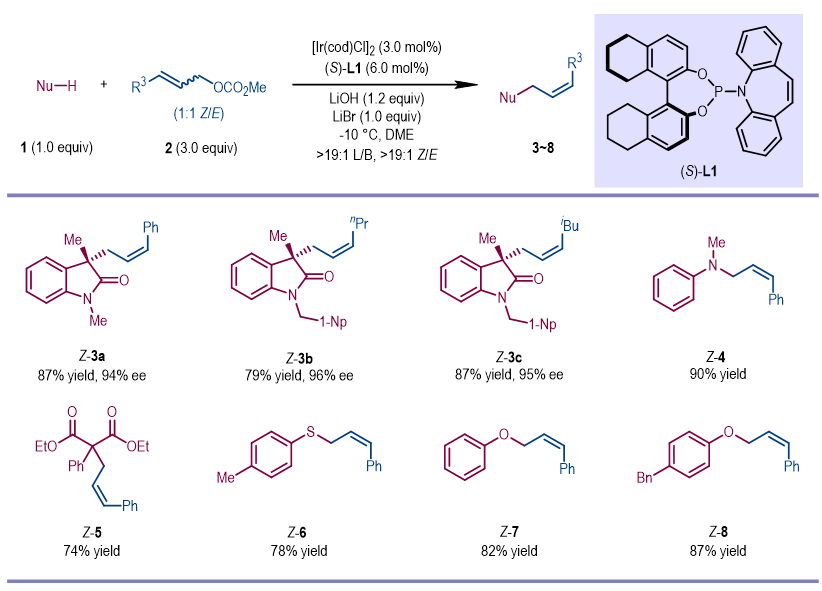
图2. 铱催化Z-选择性不对称烯丙基取代反应:以Z/E混合物为原料
研究人员进行了一系列控制实验探索该反应机制。31P NMR跟踪实验表明Z/E烯丙基底物与铱催化剂前体的氧化加成过程存在明显的速率差异。当向铱催化剂前体K1中加入过量的芳基烯丙基底物2a(Z/E =1/1,20当量)时,31P NMR谱图显示所生成的π-烯丙基铱中间体anti-K2和syn-K2的比例为3.4:1,这表明Z-2a更容易与铱催化剂发生氧化加成。同时,化学计量实验表明anti-和syn-构型π-烯丙基铱中间体接受亲核试剂进攻的速率也有所不同。以烷基π-烯丙基铱中间体anti-K3和syn-K3为例,等当量的anti-K3和syn-K3的混合物与亲核试剂1b反应,得到产物3b的Z/E比为5:1。这表明 anti-K3更容易接受亲核试剂的球外亲核进攻。综合以上两组实验结果可知,成功的铱催化Z/E烯烃动力学拆分来源于以下两个方面:Z-烯烃底物比E-烯烃底物更容易发生氧化加成;anti-构型π-烯丙基铱中间体比anti-构型π-烯丙基铱中间体更容易接受亲核进攻。

图3. 机理实验
研究人员进一步将可见光促进的烯烃E/Z异构化与铱催化Z/E烯烃动力学拆分结合起来,可以从易得的E-烯烃底物出发合成手性Z-烯烃分子。该反应可以兼容一系列E-烯烃原料和氧化吲哚亲核试剂。
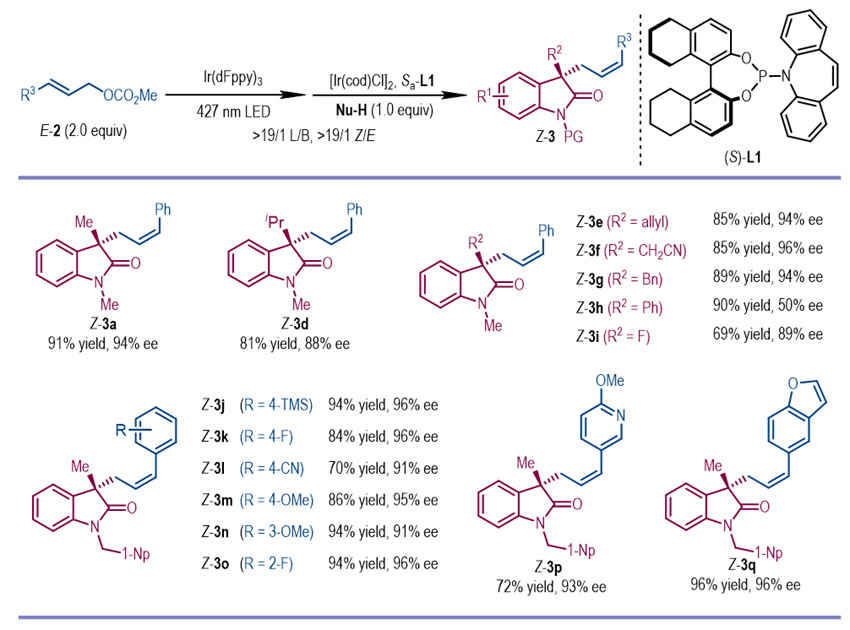
图4. 底物拓展-反式烯丙基底物
上述研究成果以全文形式发表在Journal of the American Chemical Society 上,游书力研究员和郑超研究员是论文的通讯作者,博士研究生侯一鸣是论文的第一作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Iridium-Catalyzed Z-Selective Asymmetric Allylic Substitution Reaction via Z/E Kinetic Resolution
Yi-Ming Hou, Ru Jiang, Jiandong Liu, Chao Zheng*, Shu-Li You*
J. Am. Chem. Soc. 2025, DOI: 10.1021/jacs.5c05792
导师介绍
游书力
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!













































 京公网安备 11010802027423号
京公网安备 11010802027423号