CJC | Recent Advances-北京大学莫凡洋课题组:自由基机理的硼化方法的近期研究进展
本文来源于Chinese Journal of Chemistry, 欢迎浏览!
论文信息

研究背景
有机硼化合物具有无毒性、广泛的药理活性、与生物靶点成键能力强等特点,在药物的发现与开发中占据了重要地位。早在1979年,诺贝尔化学奖便授予了两位杰出的化学家Herbert C. Brown和Georg Wittig,以表彰他们对于有机硼试剂和有机磷试剂的开发及其在有机合成中的应用这一开创性贡献,奠定了硼化反应在有机化学中的基础。另外,2010年获得诺贝尔化学奖的日本化学家Suzuki,其代表工作是在碱的作用下,钯催化的有机硼化合物与卤代烃的偶联反应,这一反应也称为Suzuki-Miyaura偶联。
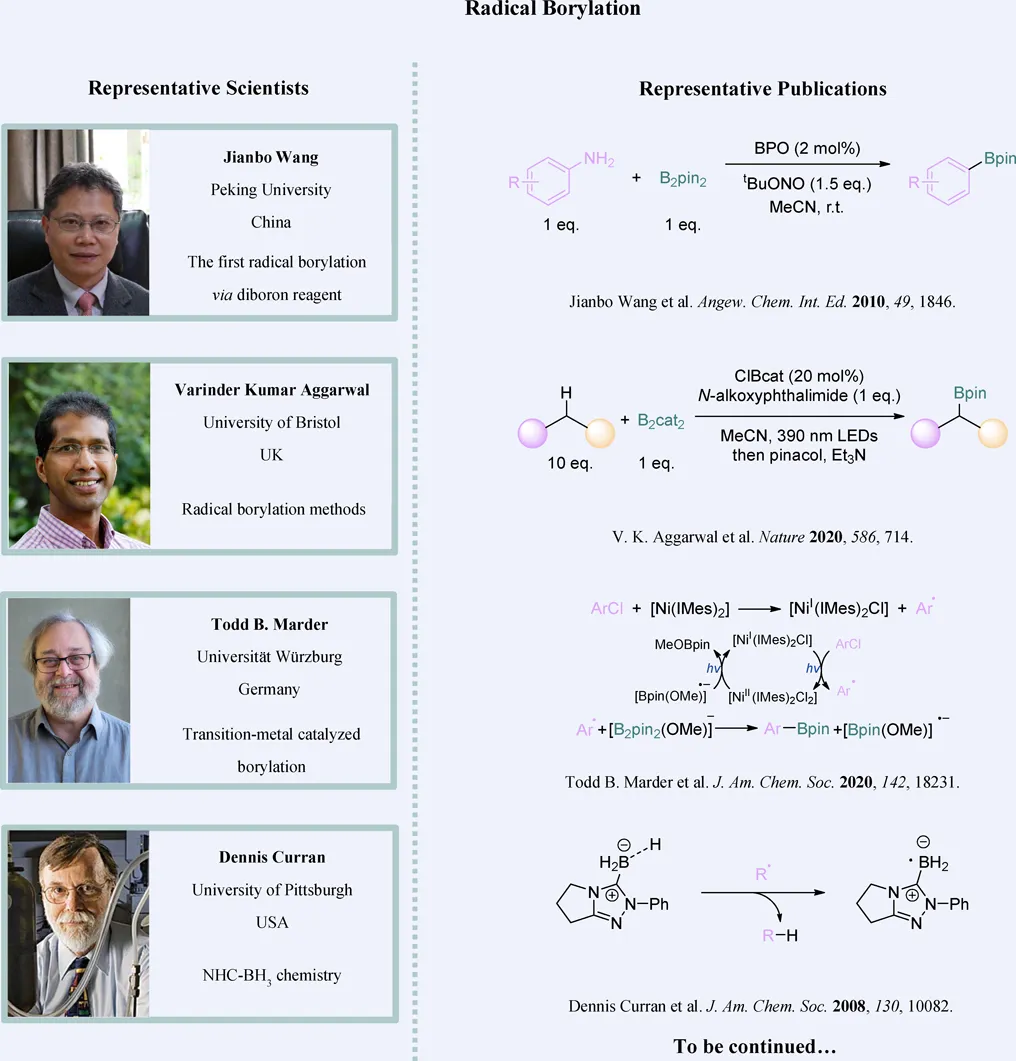
自由基硼化反应是一种绿色高效的合成方法,温和的反应条件和良好的官能团兼容性使得这一类反应在有机合成领域具有显著优势。2010年,北京大学莫凡洋和王剑波首次实现了经由自由基机理的硼化反应。反应使用芳香胺、亚硝酸叔丁酯与联硼酸频哪醇酯作为原料,一步合成芳香硼酸脂 (Angew. Chem. Int. Ed. 2010, 49, 1846)。在此之后,基于自由基机理的有机硼酯化化反应得以发展,并且发展为一类构建碳-硼键的重要方法。
研究简介
近期,由北京大学莫凡洋课题组撰写的综述文章“Recent Advances in Methodologies for Radical-Mechanistic” 聚焦于碳自由基和硼中心自由基的硼化新方法,系统回顾了自2020年以来自由基硼化领域的最新研究进展。自由基硼化的研究可分为两大方向:一种是通过卤代物、羧酸及其衍生物等前体生成烷基或芳基碳自由基,再与联硼试剂反应,生成有机硼酸酯;另一种则是由N-杂环卡宾硼烷出发,生成活性硼中心自由基后与底物反应,以实现高效硼化。这些方法不仅适用于高效构建碳-硼键的方法学研究,也为药物分子及功能性材料的合成提供了新的策略。同时,作者还探讨了实现选择性高的碳-氢键和碳-碳键硼化的挑战,自由基硼化的研究可通过引入新型自由基前体以及设计更具选择性的硼化试剂出发,进一步提升这类反应在有机合成中的应用潜力。
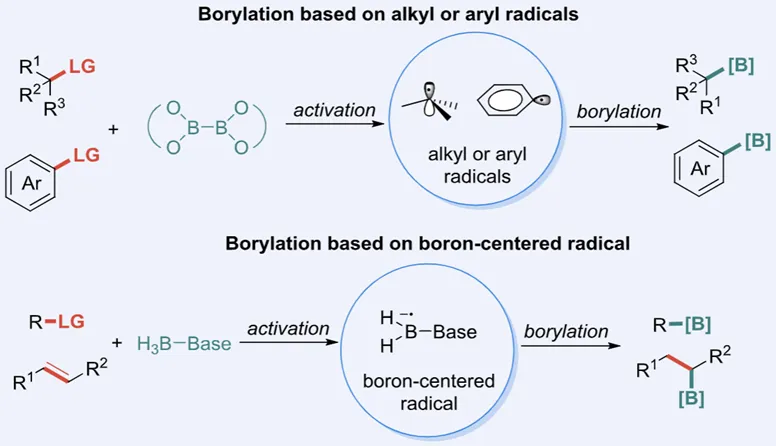
图1 自由基机理的硼化反应策略
上述综述文章已发表于Chin. J. Chem. (2025, 43, 104-115, DOI: 10.1002/cjoc.202400694)。该工作得到了国家自然科学基金的资助。
期刊简介

Chinese Journal of Chemistry 由中国顶级研究机构——中国科学院上海有机化学研究所(SIOC, CAS)和中国化学会共同呈现。自2018年以来,我们进行了重新设计,并引入了几种独特的文章类型。我们正在出版涵盖化学所有领域的高质量文章,并不断扩大国际影响力。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!













































 京公网安备 11010802027423号
京公网安备 11010802027423号