新加坡国立大学许民瑜教授课题组Nat. Synth.:铁催化联烯双烷基化合成Z式烯烃
立体定向的三取代烯烃不仅是生物活性分子的关键成分,而且还可以参与各种立体特异性反应以构建sp3-杂化的分子骨架。然而,如何高选择性地构建Z-三取代烯烃仍极具挑战性,这是因为其结构存在较大的空间排斥,进而在热力学上不太有利(图1a)。迄今为止,化学家利用动力学控制来制备Z-三取代烯烃的方法少之又少(图1b),包括:碱介导的羰基烯化、炔烃碳官能团化、烯丙醇或Z-烯基碘化物的立体保留交叉复分解和交叉偶联反应,而且这些方法大多需要繁复的合成步骤、苛刻的反应条件以及预先安装活化基/导向基,严重地限制了合成应用。另一方面,尽管联烯的碳官能团化反应可直接获得无环三取代烯烃,但是目前相关的研究较少并且底物范围十分有限。
近日,新加坡国立大学的许民瑜(Ming Joo Koh)教授(点击查看介绍)课题组报道了铁催化联烯、二烷基锌化合物和卤代烷烃的多组分反应(图1d),以优异的区域选择性和Z-选择性构建了一系列三取代烯烃,包括葡萄糖神经酰胺合成酶(GCS)抑制剂。具体过程如下(图1c):首先,Fe-X物种I与烷基锌化物2通过转金属得到烷基铁物种II,II与联烯1经自由基介导的位点选择性铁烷基化形成烯基铁中间体III,此时III会存在Z-或E-异构体,因此必须通过动力学控制来选择性形成Z-III。随后,III与卤代烷烃亲电试剂3进行C-C键偶联便可得到所需的三取代烯烃产物4。另外,机理研究表明该反应是由动力学控制的(即自由基介导位阻较小C=C键的铁烷基化和通过还原消除进行的内球烷基化),这与金属催化联烯官能团化反应的传统机制形成鲜明对比。许民瑜教授和香港中文大学的章兴龙助理教授为共同通讯作者。相关成果发表在Nature Synthesis上,文章第一作者为许民瑜教授团队檀同德博士。
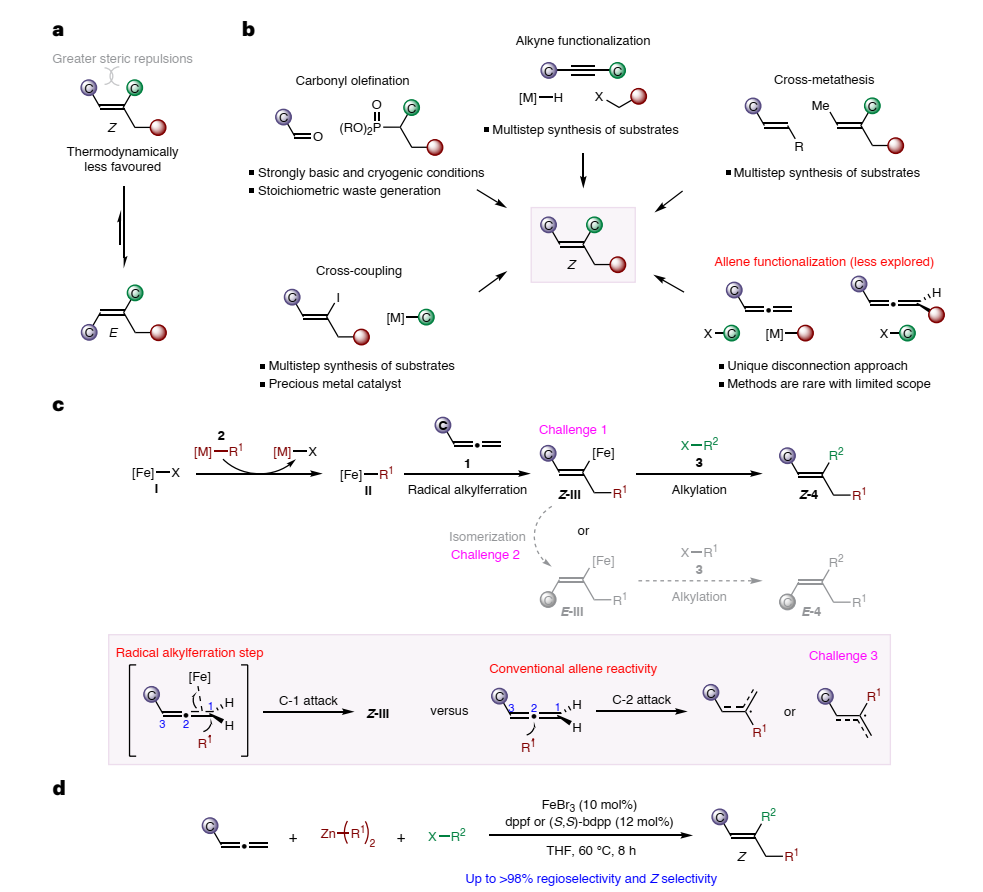
图1. 合成三取代Z-烯烃的挑战和策略。图片来源:Nat. Synth.
首先,作者选择联烯5、二乙基锌6和异戊烯基溴7为模型底物对Fe催化剂进行筛选(图2),结果显示在无配体的条件下使用10 mol% FeBr3作为催化剂进行反应时,能以67%的产率和90:10 Z:E比获得所需的三取代烯烃8。尽管反应过程中区域异构体9和10的形成很少,但是作者检测到少量的副产物11和12,进一步凸显出该反应在选择性方面的复杂性和难度。随后,作者探索了不同配体的反应效果,发现1,1'-双(二苯基膦)二茂铁L8能以71%的产率、>98%的位点选择性和94%的Z-选择性得到产物8,而三齿/双齿氮基配体L1-L3则抑制了反应并产生了大量的区域异构体9和10。
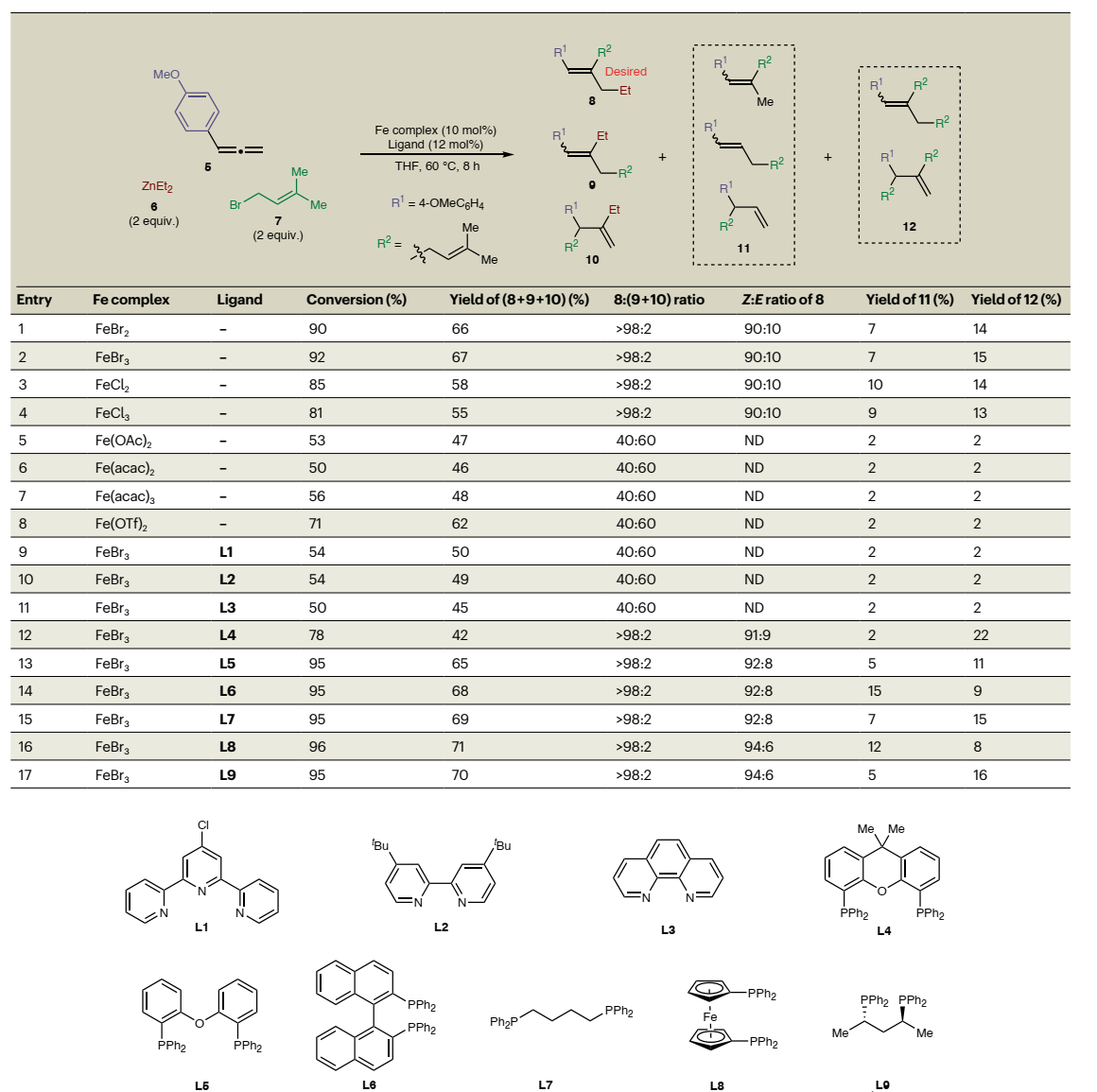
图2. 反应条件优化。图片来源:Nat. Synth.
在最优条件下,作者对联烯的底物范围进行了考察(图3),结果显示带有富/缺电子基团的芳基/杂芳基取代的联烯(8、14-27)以及1,1-二取代联烯(28-30)均能兼容该反应,以中等至良好的产率和Z-选择性以及优异的区域选择性获得相应产物,尽管带有较大空间位阻基团的联烯(20、24、25)观察到立体选择性略有降低。然而,三取代联烯(31)和烷基取代的联烯底物(32、33)进行反应时转化率较差。
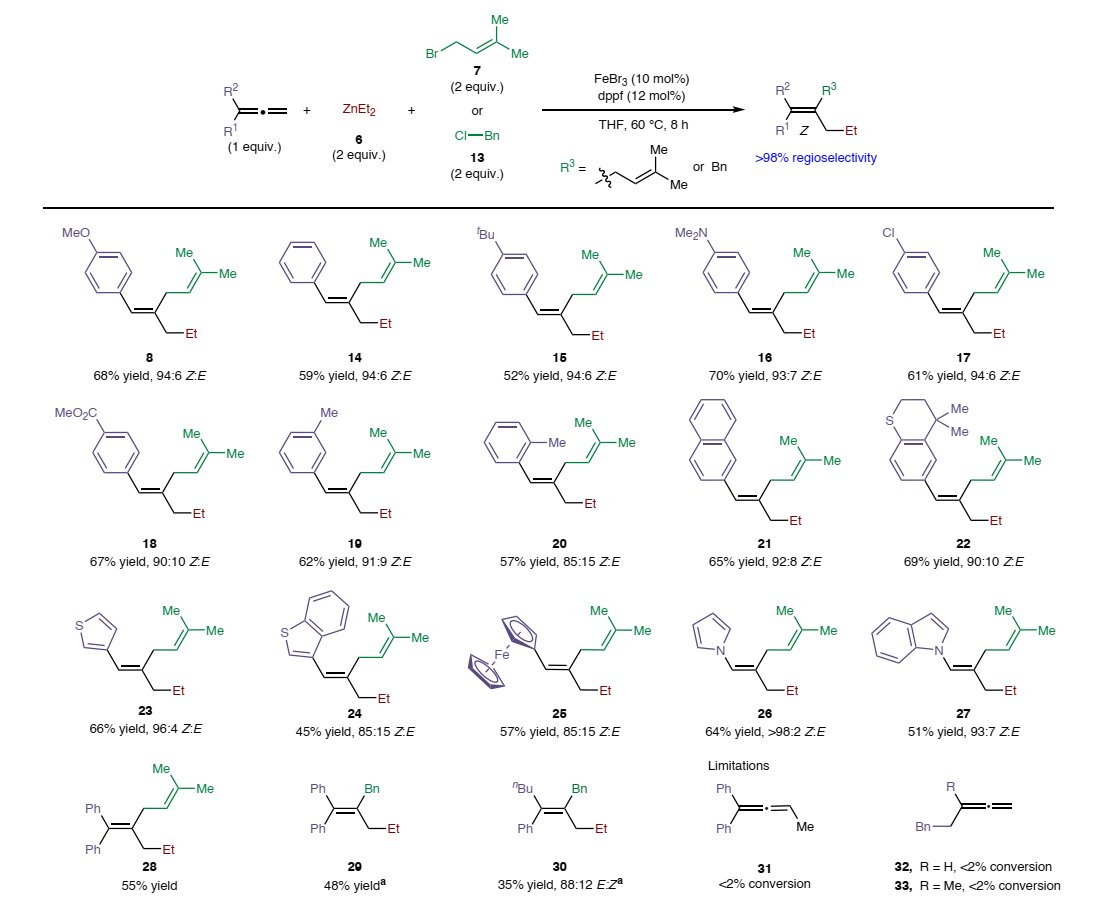
图3. 联烯的底物范围。图片来源:Nat. Synth.
接下来,作者探索了多组分反应中脂肪族亲电试剂的底物适用性(图4a),发现烯丙基和苄基卤化物(34-41)均能以优异的位点选择性和Z-选择性转化为所需的三取代烯烃,特别是产物37在C(sp2)-卤化物的存在下化学选择性地与C(sp3)-卤化物进行偶联,从而实现正交官能团化。然而,简单的伯烷基卤化物无法参与该反应,但是大位阻烷基亲电试剂(如:叔烷基和全氟烷基卤化物)却能参与二烷基化反应,尽管形成热力学上有利的E-三取代烯烃(42、43),这可能是由于最初形成的烯基铁物种Z-III与大位阻卤代烷之间的反应更缓慢,进而允许在第二个C-C键形成前Z-III竞争性地异构化为E-III。类似地,一系列二烷基锌试剂也能顺利实现这一转化(图4b),从而区域选择性地在联烯末端安装伯(44-51)、仲(52-54)和叔(55)烷基取代基。如图4c所示,作者还利用铁催化的二烷基化反应来简明合成葡萄糖神经酰胺合成酶(GCS)抑制剂,具体而言:联烯56经铁催化的二烷基化反应以40%的产率、>98:2 r.r.和91:9 Z:E得到三取代烯烃57,后者经脱保护和烷基化两步转化得到中间体58(总产率:81%),最后与Et2NH进行胺化便可合成GCS抑制剂59。值得一提的是,将59中的Z-烯烃转换为E-异构体会降低生物活性,这进一步表明了Z-选择性二烷基化反应的应用价值。
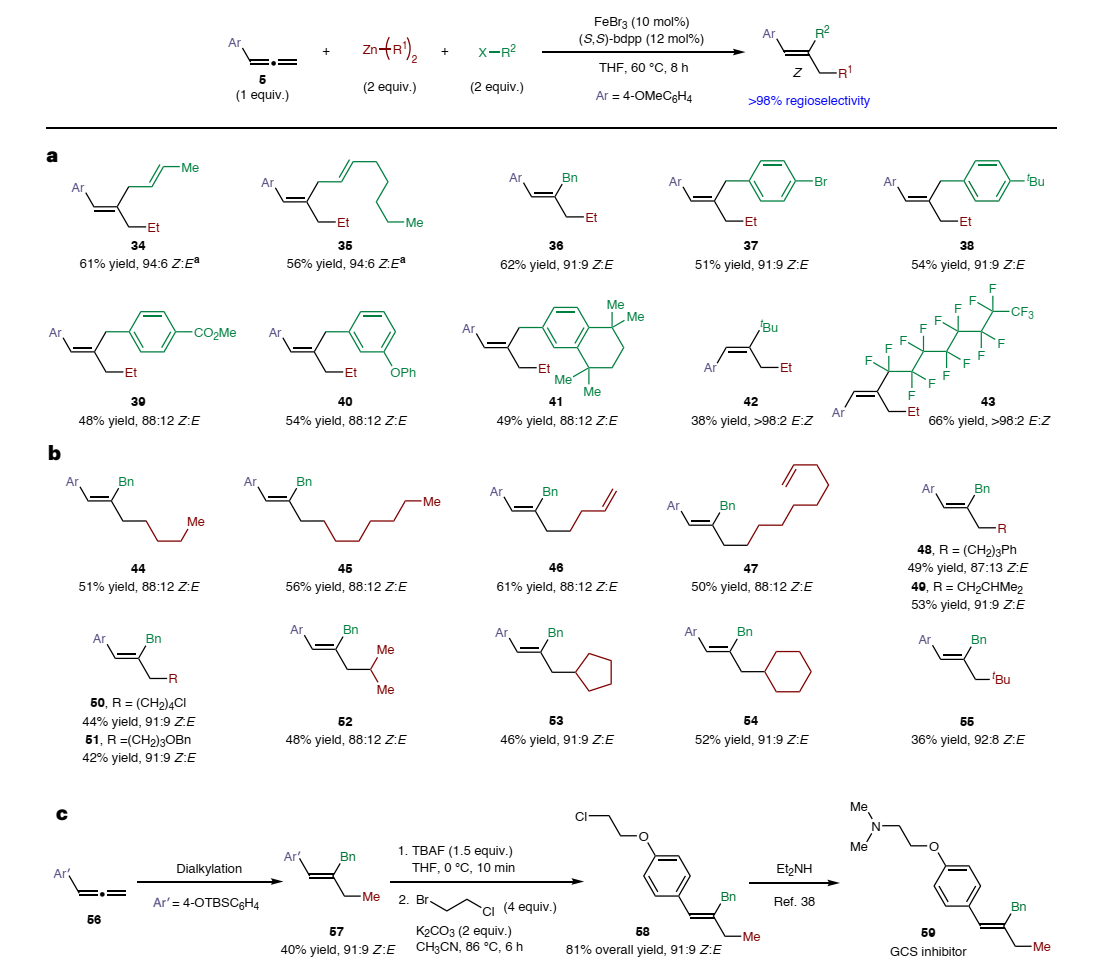
图4. 亲电试剂/亲核试剂的底物适用性及合成应用。图片来源:Nat. Synth.
为了进一步探究反应机理,作者进行了一系列控制实验:1)联烯5、苄基氯13和1-己烯衍生的二烷基锌60在标准条件下进行反应时得到了61和62的混合物(图4a),其中62的形成可以通过60原位生成5-己烯基自由基物种来解释,其可能在与联烯反应前环化为环戊基甲基自由基;2)在铁催化联烯5、二乙基锌6和异戊烯基溴7的三组分反应中,作者还检测到异戊烯基溴7的自由基自偶联副产物(图4b),而向反应体系中加入自由基抑制剂(如:TEMPO)后反应无法进行(转化率<5%),这些结果说明二烷基锌试剂产生了自由基中间体;3)在43的形成过程中检测到少量乙基溴,这主要源于二乙基锌6和全氟溴辛烷之间的背景反应,进而说明亲电全氟辛基自由基可能是由全氟溴辛烷通过有机铁物种攫取溴原子产生的,而非通过涉及乙基自由基的溴原子转移过程。最后,作者进行了密度泛函理论(DFT)计算(图4c),结果显示活性双膦-FeIIBrEt物种I的五重态最稳定,其可能是由FeIIIBr3的初始还原、与二乙基锌6的转金属化形成,或者由催化循环结束时Fe(I)物种与Fe(III)物种之间的归中反应产生。随后,联烯底物与I的铁中心进行配位并引发乙基自由基的释放,接着乙基自由基通过外球机制(TS1)加成到联烯位阻最小的C1位并得到Z-烯基铁中间体IV,该过程的能垒为27.4 kcal mol-1;而经过渡态TS1′获得E-烯基铁中间体IV′的竞争途径却具有较高的活化能垒(30.8 kcal mol-1),这可能是由于联烯的C1=C2双键与TS1的铁中心配位,因此当乙基自由基加成到末端C1碳时π-电子会反馈到Fe的d轨道。然后,异戊烯基自由基(由有机铁物种原位攫取异戊烯基溴7的溴原子生成)与IV进行配位并得到中间体V,后者的四重态(-13.4 kcal mol-1)和六重态(-13.9 kcal mol-1)能量相当。在四重态中,异戊烯基自由基与铁中心配位并经过渡态TS2促进内球还原性C(sp2)-C(sp3)键偶联以得到所需产物VII;在六重态中异戊烯基自由基不与铁中心配位,而是进行外球C-C键偶联,并且内球过渡态的能垒比六重态低6.2 kcal mol-1,这与铁催化烯烃二烷基化反应形成鲜明对比,后者有利于外球途径以产生C(sp3)-C(sp3)键。综上,铁烷基化步骤是不可逆的,这是因为IV→I的逆反应势垒高达48.3 kcal mol-1,远高于经过渡态TS2(14.0 kcal mol-1)从IV→VII的正向反应,同时该步骤也是速率和立体化学决速步。因此,考虑到经TS1形成IV和经TS1′形成IV′之间的活化能垒差异(ΔΔG‡=3.4 kcal mol-1),作者估计形成Z-异构体(与E-异构体相比)的动力学偏好为170:1,这与实验观察到的Z-烯烃选择性结果一致。
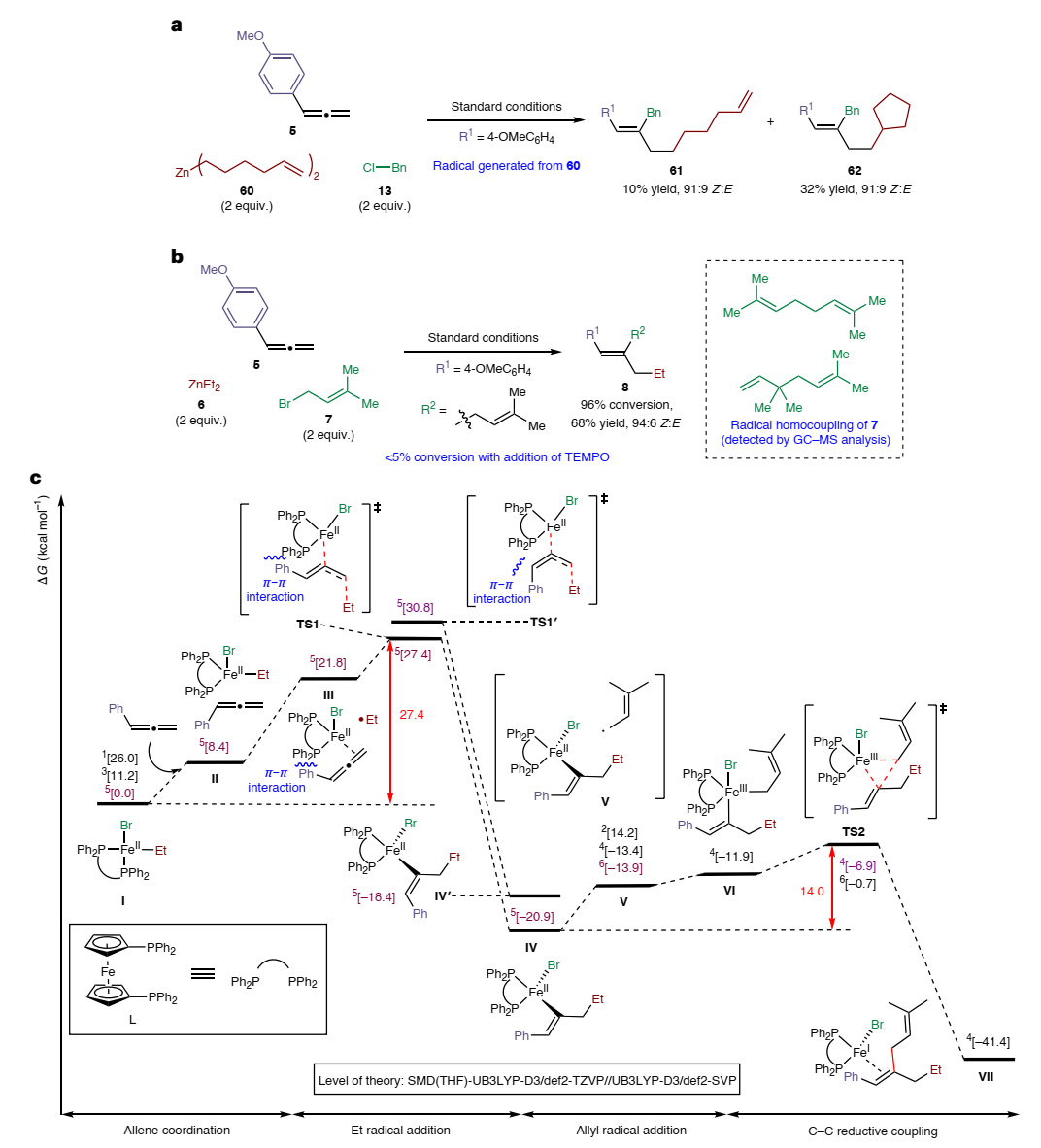
图5. 机理和计算研究。图片来源:Nat. Synth.
总结
许民瑜教授课题组报道了铁催化联烯、二烷基锌化合物和卤代烷烃的多组分反应,以优异的区域选择性和Z-选择性构建了一系列三取代烯烃,包括GCS抑制剂。另外,机理研究表明该反应是由动力学控制的(即自由基介导位阻较小C=C键的铁烷基化和通过还原消除进行的内球烷基化),这与金属催化联烯官能团化反应的传统机制形成鲜明对比。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Kinetically controlled Z-alkene synthesis using iron-catalysed allene dialkylation
Tong-De Tan, Kai Ze Tee, Xiaohua Luo, Peng-Cheng Qian, Xinglong Zhang, Ming Joo Koh
Nat. Synth., 2024, DOI: 10.1038/s44160-024-00658-7
导师介绍
许民瑜
https://www.x-mol.com/university/faculty/47854
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号