Science:有光明还要有黑暗,3D打印水凝胶才能更弹
数字光处理(digital light processing,DLP)作为一种光聚合技术,是目前最热门的3D打印技术之一。相比于传统的立体光刻技术(stereolithography,SLA),DLP采用发射器阵列,如投影仪,来代替激光光源,直接将图像投射到液态光敏树脂上,实现快速逐层构建三维物体,从而显著提高了制造模型的效率和精确度。
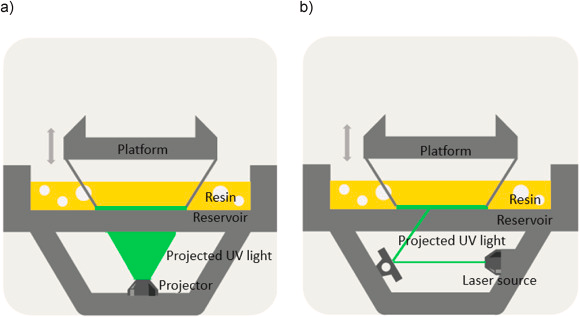
DLP(左)和SLA(右)技术示意图。图片来源:Bioprinting [1]
然而,该技术在打印速度与机械性能之间难以做到两全其美。试想一下,如果液态光敏树脂中的链段在固化过程中相互纠缠,能够在应力作用下滑动,就可以提升聚合物网络的抗疲劳性和断裂强度。而要在聚合物链形成时引入纠缠,则需要低粘度的树脂单体,同时精确控制前驱物的组成,采用低浓度的光引发剂。但是,这又会导致反应速率减慢。在“鱼和熊掌不可得兼”的情况下,科学家通常需要退而求其次,在快速固化和提高机械性能之间找到平衡,以确保打印形状的强度、精确度以及打印效率。
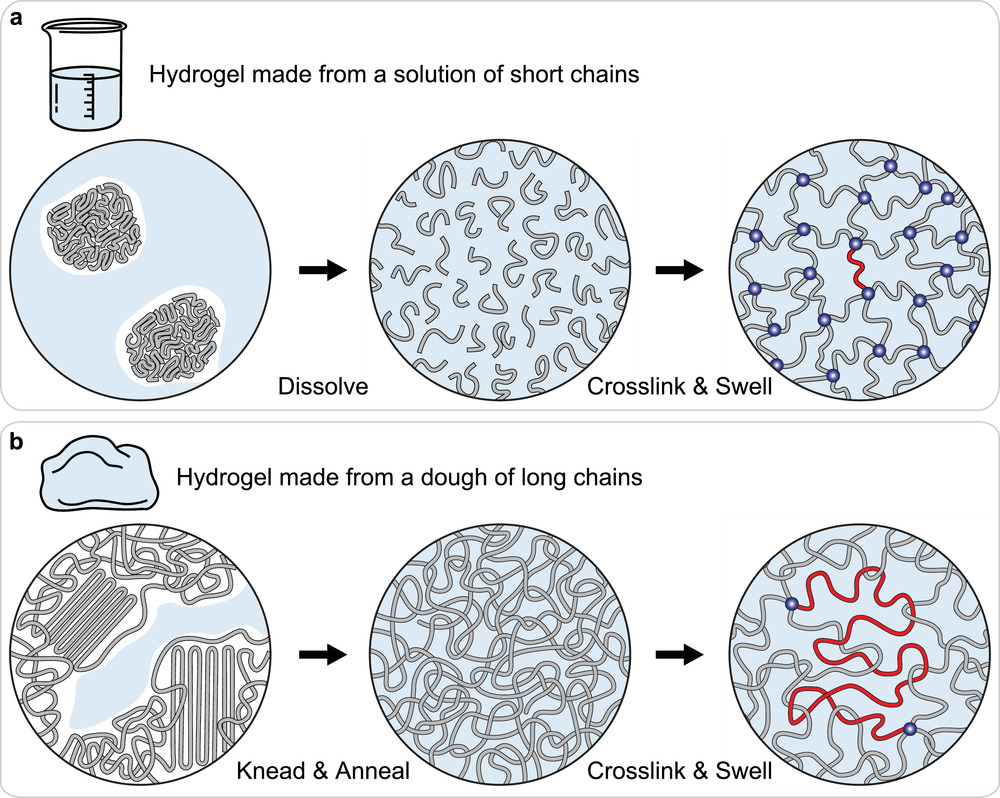
短链交联(cross-link)与长链纠缠(entanglement)。图片来源:Adv. Mater. [2]
近日,美国宾夕法尼亚大学Jason A. Burdick课题组和科罗拉多大学博尔德分校的研究者合作在Science 杂志上发表论文,报道了一种被称为“氧化还原引发辅助的曝光后连续固化”(continuous-curing after light exposure aided by redox initiation,CLEAR)的简单新技术,以解决上述问题。CLEAR结合了光聚合和暗聚合,单体首先通过光引发快速聚合(即“光聚合”)来构建物体形状,而其中未反应的单体再通过较慢的氧化还原反应(即“暗聚合”)继续转化直至反应完全,形成高度纠缠的聚合物链。连续固化过程在室温下进行,不需要涉及光或热的额外步骤。与传统DLP方法相比,CLEAR打印的水凝胶表现出更高的弹性,拉伸性能提高了4~7倍,在快速可编程3D打印,尤其是生物医学制造中具有广泛的应用潜力。

CLEAR法3D打印生物材料。图片来源:科罗拉多大学 [3]
研究者选择丙烯酰胺作为单体,使用低浓度的双丙烯酰胺作为交联剂。光照后,DLP和CLEAR技术中的单体转化率均接近20%。由于快速引发和不完全转化,此时形成的聚合物链段较短,且纠缠程度较低。而在CLEAR技术中,由于添加了氧化还原引发剂,单体在固化后可以在室温条件下继续转化,最终转化率稳步升至100%,形成高浓度的相互纠缠的聚合物链。
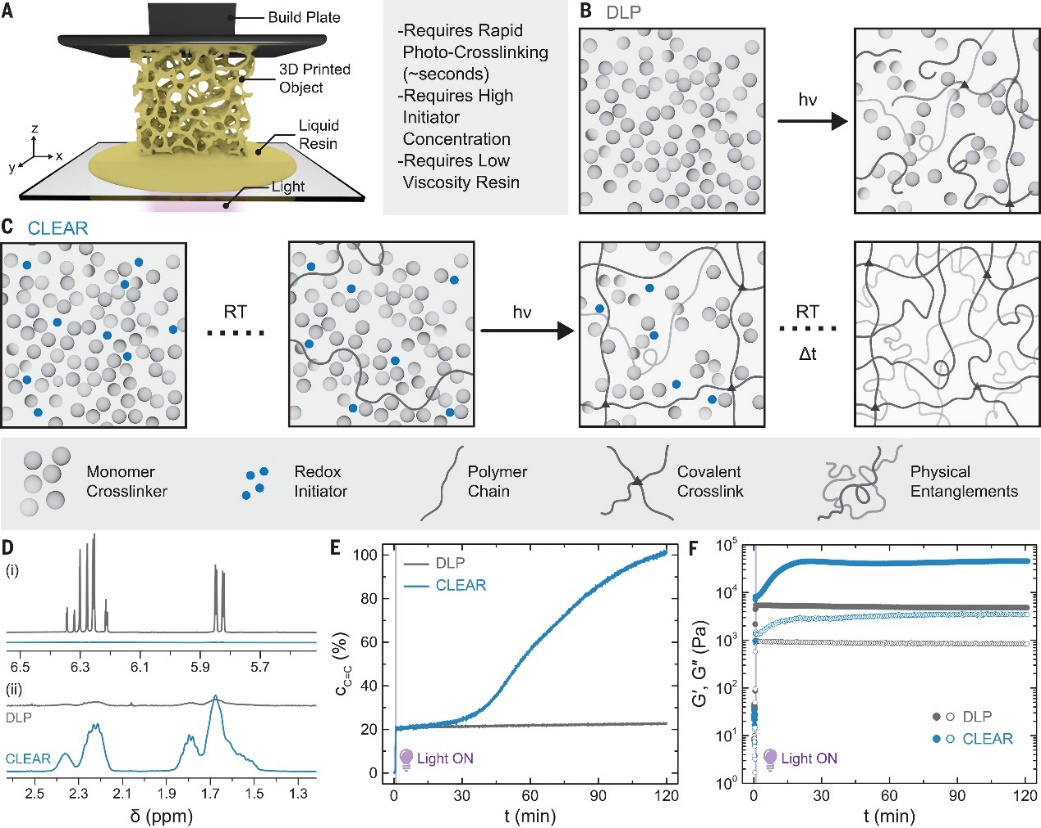
CLEAR打印技术。图片来源:Science
与DLP打印的水凝胶相比,CLEAR打印的水凝胶的拉伸弹性模量和断裂功分别提高了近两倍和四倍,表现出完美的弹性,能够在拉伸时承受高达250千帕的标称应力(相当于接近1兆帕的真实拉伸强度),而DLP打印的水凝胶在较低拉伸强度下,就会发生失效断裂。

拉伸性能演示实验。图片来源:Science
由于在原子尺度上直接表征分子纠缠比例非常困难,研究者采用了间接测量的方法。与DLP相比,CLEAR打印的水凝胶的溶解速度明显更慢,且凝胶渗透色谱(GPC)等测试显示,两者的分子量相似,证明了溶解速度降低是由于高密度纠缠引起的。因此,研究者推测,CLEAR打印水凝胶的拉伸强度增加,应该归因于更高的单体转化率以及链纠缠密度。
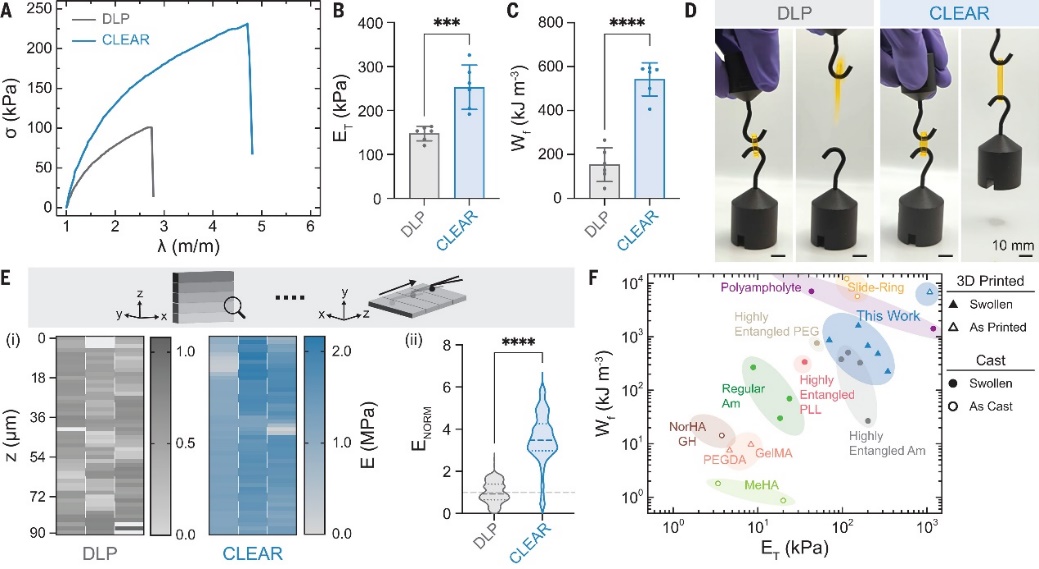
CLEAR打印水凝胶的机械性能。图片来源:Science
CLEAR技术可以打印多种复杂的拓扑结构,如骨结构、八面体桁架等等,DLP和CLEAR均能实现高打印分辨率和精度(~400 μm),且氧化还原反应诱导的暗聚合并不会对分辨率产生影响。然而,后者具有更好的弹性,例如,打印的负泊松比八面体桁架在承受压缩后,可以恢复其原始形状而不发生塑性变形。此外,CLEAR技术具有广泛的普适性,可用于多种单体的打印。
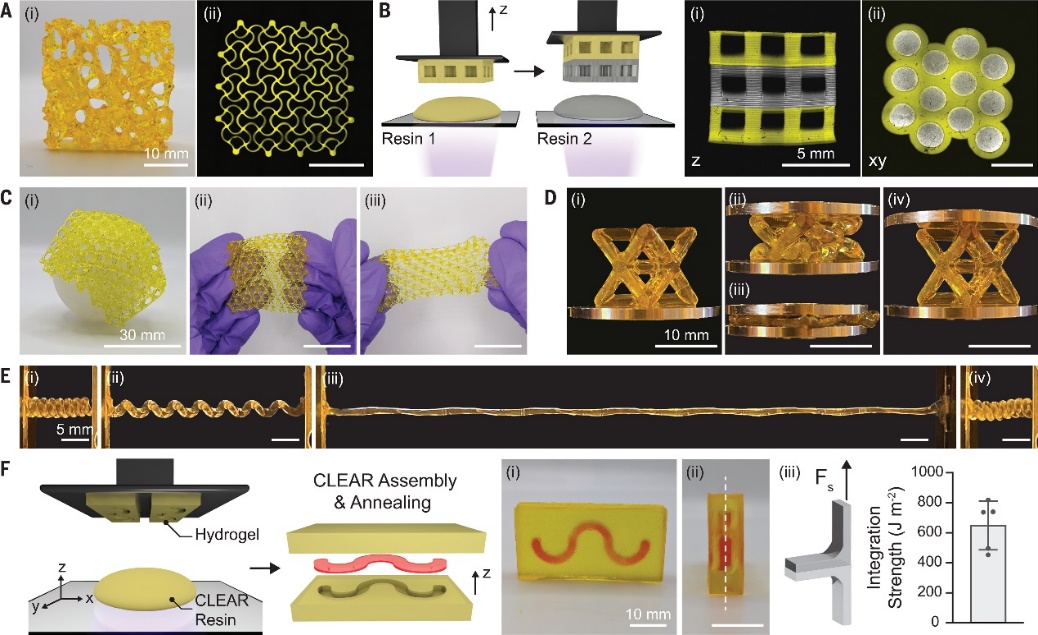
CLEAR打印复杂的拓扑结构。图片来源:Science

CLEAR打印八面体桁架的压缩与恢复。图片来源:Science
高度纠缠的水凝胶材料,在生物粘附领域展现了广泛的应用前景。例如,可以打印出沟道结构,黏附在组织表面,用作局部药物输送通道;或利用图案化结构,区分粘性部分和非粘性部分,使水凝胶与组织紧密黏结,又不损伤底层基质;也可以将水凝胶层与弹性体整合,形成具有组织粘附性的功能性水凝胶-弹性体混合物,从而克服聚合物渗透性低的问题。
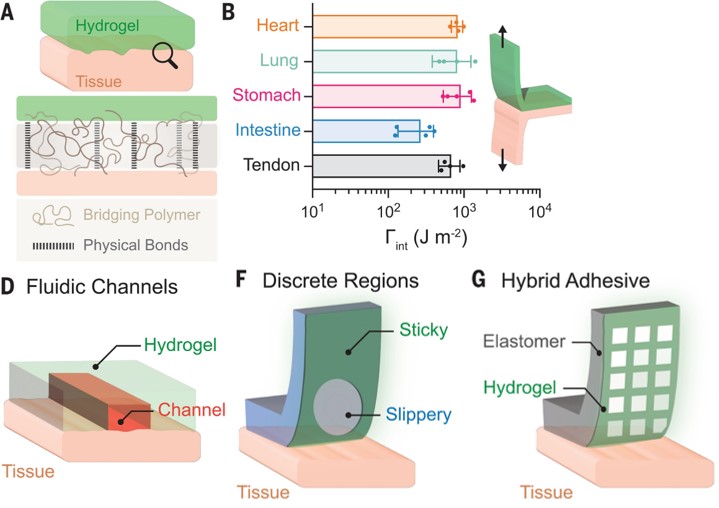
CLEAR打印水凝胶的生物应用。图片来源:Science
“DLP打印技术通常需要快速光固化,这需要相对较高的光引发剂浓度,进而牺牲部分机械性能”,论文的第一作者Abhishek Dhand说道,“我们开发的CLEAR方法结合了光聚合和暗聚合,完美地解决了这一限制,使未反应的单体完全转化,打印出既坚韧又具有弹性的复杂结构”,“这解决了3D打印中的一个大问题”。[3]
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Additive manufacturing of highly entangled polymer networks
Abhishek P. Dhand, Matthew D. Davidson, Hannah M. Zlotnick, Thomas J. Kolibaba, Jason P. Killgore, Jason A. Burdick
Science 2024, 385, 566-572. DOI: 10.1126/science.adn6925
参考文献:
[1] Y. Sun, et al., Application of 3D printing & 3D bioprinting for promoting cutaneous wound regeneration. Bioprinting 2022, 28, e00230. DOI: 10.1016/j.bprint.2022.e00230
[2] G. Nian, et al., Making Highly Elastic and Tough Hydrogels from Doughs. Adv. Mater. 2022, 34, 2206577. DOI: 10.1002/adma.202206577
[3] A 3D-printed Band-Aid for the Heart?
(本文由小希供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号