新颖糖肽cihanmycin中P450催化分子内苯酚偶联反应机制的解析
在化学生物学领域,细胞色素P450酶因其独特、多样的催化能力而备受瞩目。P450酶催化的分子内C−O和C−C苯酚偶联反应在天然产物生物合成中扮演着关键角色,广泛存在于糖肽类抗生素如万古霉素和替考拉宁中。虽然糖肽类抗生素中多个催化分子内苯酚偶联反应P450酶的功能和晶体结构相继被解析,但底物复合物结构的缺失导致该类反应的催化机制一直是未解之谜。
近日,中国科学院南海海洋研究所张长生研究员(点击查看介绍)团队和厦门大学王斌举教授(点击查看介绍)团队合作解析了新颖糖肽cihanmycin中P450酶催化分子内苯酚偶联反应的机制。首先,研究团队从放线菌Amycolatopsis cihanbeyliensis DSM 45679中发现了C−O连接的新型双环糖肽类化合物cihanmycins(CHMs,图1)。CHM A (1) 的结构通过X-ray单晶衍射确定为双环糖肽,包含肉桂酰基团和两个在天然产物中极其罕见的D-阿拉伯呋喃糖。接着,基于生物信息学分析和异源表达实验,在DSM 45679的基因组中定位了CHM的基因簇,并通过体内基因敲除和体外生化实验证实了3个P450酶的功能:Cih26负责肉桂酰基团的环氧化和羟化,Cih32负责三个氨基酸的羟化,Cih33及其同源蛋白DmlH和EpcH催化分子内C−O苯酚偶联反应形成CHM的双环骨架(图1)。
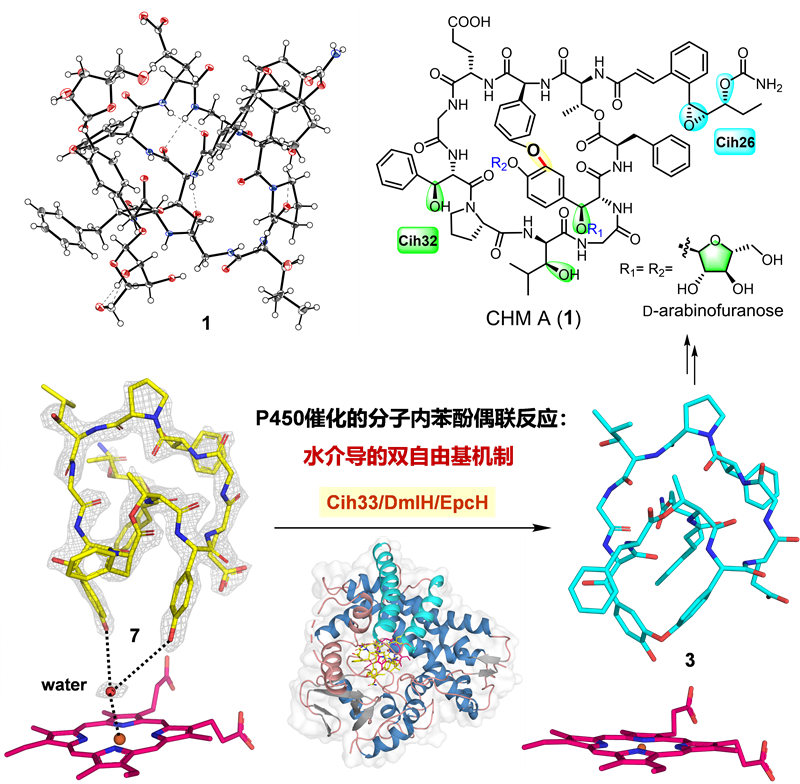
图1. CHM生物合成中3个P450酶的功能
为揭示Cih33及其同源蛋白催化C−O苯酚偶联反应的机制,研究团队开展了晶体学研究并解析了DmlH和DmlH−7复合物的晶体结构,首次揭开了分子内C−O苯酚偶联P450酶与大环肽结合模式的神秘面纱。同时,单环底物7的柔性结构使其NMR信号裂分复杂,难以解析结构,而DmlH−7的结构获取提供了通过复合物晶体鉴定小分子结构的经典案例。值得注意的是,底物7与DmlH的辅因子血红素(heme)平面之间有一个水分子,可能在苯酚偶联反应的攫氢过程中起关键作用。为验证这一推测,研究团队开展了分子动力学(MD)模拟和量子力学/分子力学(QM/MM)计算,揭示了DmlH催化分子内苯酚偶联反应由水介导的双自由基机制(图2),首次提出了水分子在双自由基苯酚偶联反应中的重要作用。
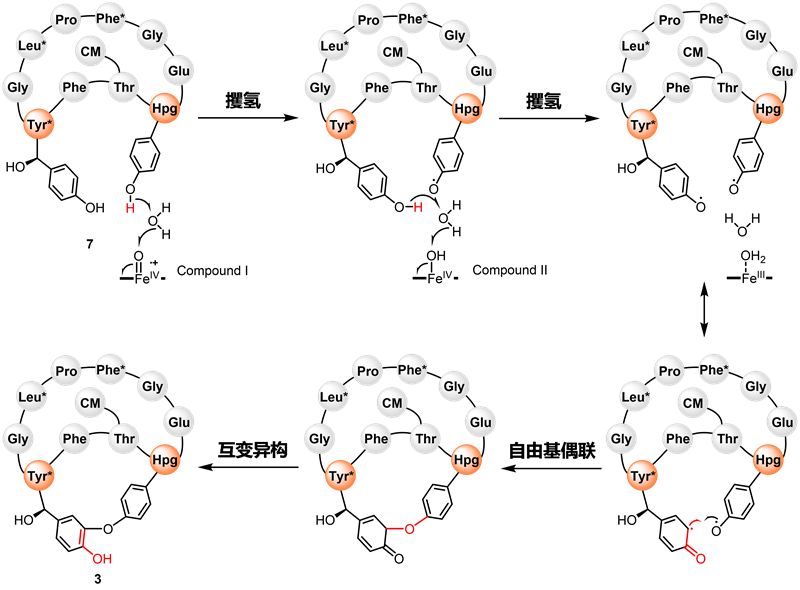
图2. 分子内苯酚偶联反应由水介导的双自由基机制(注:“*”为羟化氨基酸,“CM”为肉桂酰基团)
此外,基于生信分析,从数据库中挖掘到81个含有Cih33同源蛋白的肽类基因簇。对这些基因簇的P450酶进行系统发育分析,发现催化分子内苯酚偶联反应的Cih33/DmlH/EpcH和糖肽类抗生素的P450酶都聚集在同一分支,表明该分支中的其他P450酶可能具有相似的功能和机制,编码这些P450酶的基因簇有望产生新颖的双环肽类化合物。
综上,本研究证实了双环糖肽类化合物CHM生物合成中3个P450酶的功能,并利用酶学和计算化学等方法首次揭示了DmlH催化分子内苯酚偶联反应由水介导的双自由基机制,为深入理解P450酶催化的分子内苯酚偶联反应提供了新的视角,还为发现和开发更多新颖的双环肽类化合物奠定了研究基础,有望为抗生素研发提供更多物质基础。
这一研究成果近日发表于Journal of the American Chemical Society,方春艳博士、张丽萍副研究员和汪永超博士生为论文共同第一作者,张长生研究员、朱义广研究员和王斌举教授为共同通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Discovery and Biosynthesis of Cihanmycins Reveal Cytochrome P450-Catalyzed Intramolecular C−O Phenol Coupling Reactions.
Chunyan Fang†, Liping Zhang†, Yongchao Wang†, Weiliang Xiong, Zier Yan, Wenjun Zhang, Qingbo Zhang, Binju Wang*, Yiguang Zhu*, and Changsheng Zhang*
J. Am. Chem. Soc., 2024. DOI: 10.1021/jacs.4c02841
研究团队负责人简介
张长生,研究员,博士生导师,中国科学院南海海洋研究所副所长,中国科学院•中国-斯里兰卡联合科教中心主任。2002年于德国Wuppertal大学获博士学位,2003-2008年在美国威斯康星大学麦迪逊分校从事博士后研究,2008年3月加入中国科学院南海海洋研究所,致力于海洋微生物天然产物发现、生物合成和创新药物研发研究。在Science、Nat. Commun.、J. Am. Chem. Soc.、Mol. Cell、Angew. Chem. Int. Ed.、Sci. China Chem.、Chem. Sci.等期刊发表论文170余篇,授权专利近40件。2011年获得国家自然科学基金杰出青年基金,2014年入选科技部“中青年科技创新领军人才”、2015年入选“广东特支计划”杰出人才(南粤百杰),2016年入选国家“万人计划”科技创新领军人才,2021年入选英国皇家化学会会士。获得第四届曾呈奎海洋科技奖-青年科技奖(2016年)。现任期刊Nat. Prod. Rep.编委会成员。
张长生研究员课题组主页:
https://www.x-mol.com/university/faculty/280580
https://teacher.ucas.ac.cn/~cszhang?language=en
朱义广,研究员,博士生导师,中国科学院南海海洋研究所。2003年本科毕业于山东大学;2006年硕士毕业于河北大学;2011年博士毕业于华中农业大学。主要围绕海洋微生物次级代谢产物生物合成与基因组指导的次级代谢产物挖掘开展研究。入选和获评中国科学院南海所“南海新星”(2017)、“广东特支计划”科技创新青年拔尖人才(2019)、中国科学院广州教育基地(2021)与南海所(2020)优秀研究生指导教师。发表第一/通讯作者论文近30篇;主持国家基金、中国科学院前沿科学重点研究课题和国家重点研发计划子课题等15项;获授权发明专利18件;参与编写专著5部。
王斌举,厦门大学化学化工学院教授、博士生导师。2012年于厦门大学获得博士学位,随后在以色列希伯来大学从事博士后研究,2016年于西班牙巴塞罗那大学从事博士后研究,2018年加入厦门大学。研究领域为酶催化反应的多尺度理论模拟,主要通过量子化学计算、分子动力学模拟、量子力学/分子力学组合方法、以及从头算动力学模拟等多尺度理论模拟方法揭示金属酶催化机制、O2和H2O2在金属酶中的活化过程及含氧中间体反应性质、电子质子转移微观机理等。在对酶催化机理有深入认识的基础上,将进一步和实验课题组合作,开发设计基于金属酶的生物合成反应,用于重要药物中间体以及化学品中间体的生物合成。主持国家自然科学基金委优秀青年科学基金项目、科技部国家重点研发计划青年科学家项目、国家自然科学基金面上项目等多项课题,在Nature、Nat. Catal.、Acc. Chem. Res.、J. Am. Chem. Soc.、Nat. Commun.、Angew. Chem. Int. Ed.、ACS Catal.等期刊发表研究论文100余篇。
王斌举教授课题组主页:
https://www.x-mol.com/university/faculty/243303
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!













































 京公网安备 11010802027423号
京公网安备 11010802027423号