UCSD王栋课题组JACS:揭示DNA损伤Fapy•dG引起RNA聚合酶II转录突变的分子机制
当DNA暴露在氧化环境中时,会产生多种DNA损伤,这些DNA损伤会通过增加碱基配对时的空间位阻或改变配对的氢键模式来干扰DNA的复制和转录过程。在DNA复制过程中,通过含有DNA损伤的位点时,可能会引入错误配对的碱基,造成基因突变,进而诱发癌症等多种疾病。同样的,在DNA转录的过程中,RNA聚合酶通过DNA损伤位点时,也有可能会引入错配碱基,造成转录突变。转录突变会导致蛋白质突变和非编码RNA的功能异常,从而改变细胞表型和细胞命运,并导致一系列疾病的发生。
在DNA损伤中,Fapy·dG和8-OxodGuo是由同一个dG氧化中间体经过不同的反应过程后形成的。其中,8-OxoGuo是一种常见的DNA损伤,而Fapy·dG在细胞中的形成量与8-OxoGuo相当,并且比8-OxoGuo更易造成碱基突变。此前,研究人员通过生化和结构生物学的手段研究了Fapy·dG对DNA复制的影响,发现Fapy·dG以构型异构体混合物的形式存在于细胞中,并影响DNA复制。但是有关Fapy·dG对转录的影响,此前并没有相关的研究报道。
针对这一问题,加州大学圣地亚哥分校(UCSD)王栋教授团队与约翰霍普金斯大学Marc Greenberg教授团队展开合作,结合生化与结构生物学实验手段对Fapy·dG在转录过程中的影响进行了一系列研究。相关研究成果近期发表在Journal of the American Chemical Society 杂志上。
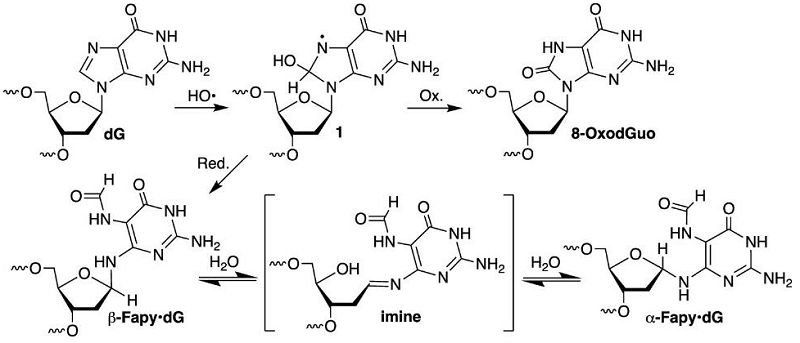
图1. DNA损伤Fapy·dG的形成途径及其两种构型异构体的形成
研究团队首先通过体外转录实验证明了Fapy·dG会阻碍RNA聚合酶II(Pol II)的转录。研究人员通过化学合成的方式,在DNA模板链的+1位置引入Fapy·dG损伤,通过体外转录实验发现,与+1位置为未损伤dG的模板相比,Pol II在碰到Fapy·dG时,转录速度明显变慢,转录合成产物的量也变少,表明Fapy·dG损伤会影响Pol II的转录。
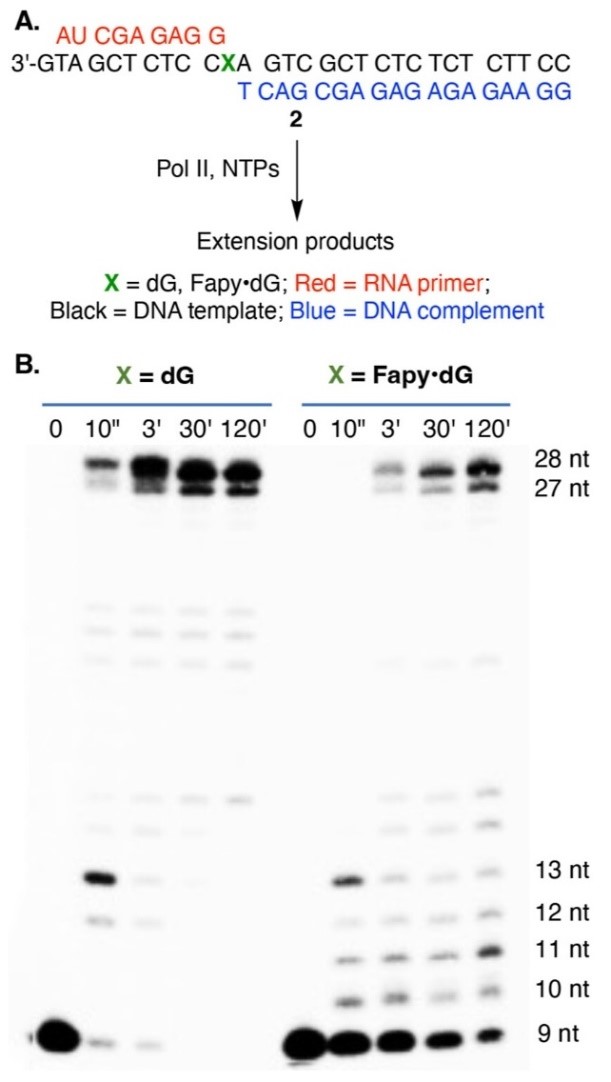
图2. RNA聚合酶II在含有DNA损伤Fapy·dG或正常dG的DNA模板上的转录结果
之后,研究人员继续利用体外转录实验对Fapy·dG如何影响三个转录准确性检查点进行研究,这三个检查点包括插入、延伸和校对。通过酶动力学分析,发现在插入与延伸的步骤中,Fapy·dG损伤的转录动力学结果都与双指数函数拟合,而不是单指数函数,这表明Fapy·dG损伤可能存在两种异构体,分别影响核苷酸插入与延伸的步骤。在核苷酸插入过程中,Pol II遇到Fapy·dG时,CTP的插入速度最快,但是与未损伤的dG相比,错配核苷酸的插入速度与CTP的插入速度的区别要小得多,表明Fapy·dG更容易在插入过程中引入错配。而在延伸过程中,Fapy·dG:A的延伸速度与Fapy·dG:C的延伸速度相当。而在校对过程中,三个错配都能被有效识别并切割,但是Fapy·dG:A的切割效率最低。表明Fapy·dG对三个检查点都有影响,并且与未损伤的dG相比,Fapy·dG更容易引入错配。

图3. RNA聚合酶II在含有Fapy·dG的DNA模板上进行插入、延伸和校对的酶动力学结果
接着,研究人员利用结构生物学手段对Fapy·dG如何影响核苷酸的插入进行了研究。首先解析了含有Fapy·dG损伤的Pol II转录复合物的结构,发现Fapy·dG与未损伤的dG同样处于+1的位置。
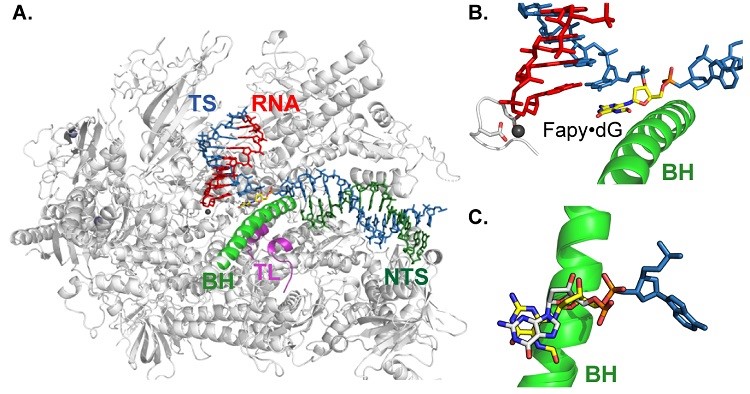
图4. 含有Fapy·dG损伤的RNA聚合酶II转录复合物的结构
由于在之前的生化实验结果表明,Fapy·dG:A的错配倾向最高,因此,以ATP的插入为例进行错配的结构研究,解析了另外四种晶体结构,包括两种底物结合状态(无错误的CTP和错配的ATP)和两种反应后的插入状态(无错误的CTP和错配的ATP)。结构表明,CTP更容易与Fapy·dG配对并插入,而ATP更倾向于结合在入口位点,这表明Fapy·dG:ATP之间的氢键作用没有Fapy·dG:CTP那样强,无法保持底物在结合位点。而在反应后的结构中,CTP和ATP都可以被插入到RNA链中,这表明化学反应可以帮助ATP从入口位点转移到结合位点并插入到RNA链中。
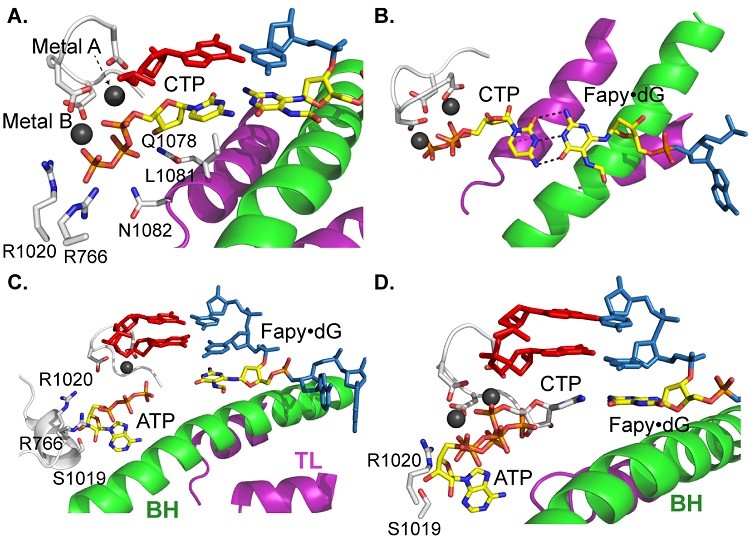
图5. 核苷酸底物CTP(无错误)或ATP(易错)结合在转录活性中心的结构
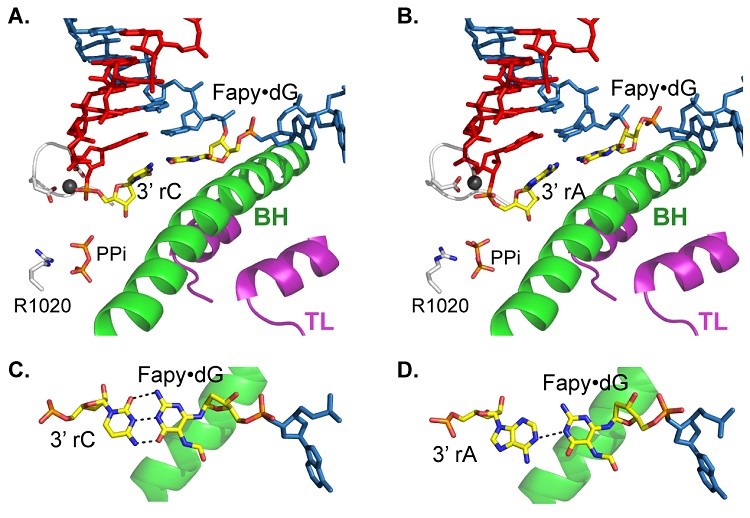
图6. 核苷酸底物CTP(无错误)或ATP(易错)插入到RNA链末端后与Fapy·dG的配对模型
以上研究为Fapy·dG对转录过程的影响提供了动力学和结构基础,可以帮助更好地理解Fapy·dG损伤如何影响转录与疾病发生。
UCSD王栋教授以及约翰霍普金斯大学Marc Greenberg教授为论文的共同通讯作者,Marc Greenberg课题组博士生高仕君、王栋课题组博士后侯佩妮和韩国庆熙大学Juntaek Oh教授为该论文的共同第一作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Molecular Mechanism of RNA Polymerase II Transcriptional Mutagenesis by the Epimerizable DNA Lesion, Fapy•dG
Shijun Gao, Peini Hou, Juntaek Oh, Dong Wang*, and Marc M. Greenberg*
J. Am. Chem. Soc., 2024, 146, 6274–6282, DOI: 10.1021/jacs.3c14476
王栋教授简介
王栋,加州大学圣地亚哥分校Skaggs School of Pharmacy and Pharmaceutical Sciences教授。1998年于北京大学取得学士学位,2004年于MIT取得博士学位,2005年至2009年在斯坦福大学Roger Kornberg教授实验室从事博后研究。2010年入职加州大学圣地亚哥分校。研究领域侧重于理解细胞应对DNA损伤的机制,特别是转录和表观遗传修饰与DNA损伤之间的功能互作。团队采用多学科方法,结合结构生物学、生物化学、计算生物学和遗传学等手段,研究参与DNA损伤识别和损伤修复的关键蛋白复合物。相关研究成果发表在Nature,Cell,PNAS,JACS,Nature Communications,NAR等杂志。
课题组网站:
https://dongwang.ucsd.edu/research
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号