北京大学陈鹏课题组Nat. Chem.等系列进展:活细胞剪切化学打造蛋白质脱笼工具箱
注:文末有生物正交剪切反应与蛋白质脱笼工具箱简介
蛋白质被认为是执行生命活动的最重要的分子机器之一,参与并调控着几乎所有的生物过程。在活细胞中利用化学反应对蛋白质的功能进行调控可以揭示细胞内分子作用机制,赋予蛋白质新的功能,并推动新的医疗手段的发展。
在组成蛋白质的二十种天然氨基酸中,色氨酸是介导分子相互作用类型最多、也最“昂贵”的氨基酸,其生物合成的“成本”远超其他天然氨基酸,且只由UGG一个密码子编码 [1]。由于色氨酸的独特性和稀缺性,色氨酸往往出现在蛋白质的关键位点,稳定蛋白质结构、调节蛋白质构象、调控蛋白质相互作用、参与分子识别和催化等重要过程 [2-3]。如果能够在活细胞内精准操纵特定色氨酸的功能及相互作用,就有望获得一种特异激活含色氨酸蛋白质的通用技术。然而目前尚无对色氨酸进行“可逆化学编辑”的相关报道。
近日,北京大学陈鹏/樊新元团队与浙江大学林世贤团队合作,在Nature Chemistry 杂志在线发表研究论文,报道了一种能在活细胞中“笼锁”和“脱笼解锁”蛋白质中任意色氨酸功能的通用方法(Trp-CAGE,图1)。该方法利用基因密码子扩展技术将“笼锁”色氨酸(Caged Tryptophan)引入目标蛋白的特定位点,实现其功能的暂时屏蔽;然后,利用新发展的生物正交剪切反应在活细胞中完成可控 “脱笼”,实现各类蛋白质家族的精准“激活”和功能解析。通过计算机模型预测,该“色氨酸脱笼”技术可对超过28000个来自不同物种的候选蛋白质进行功能获得性研究。
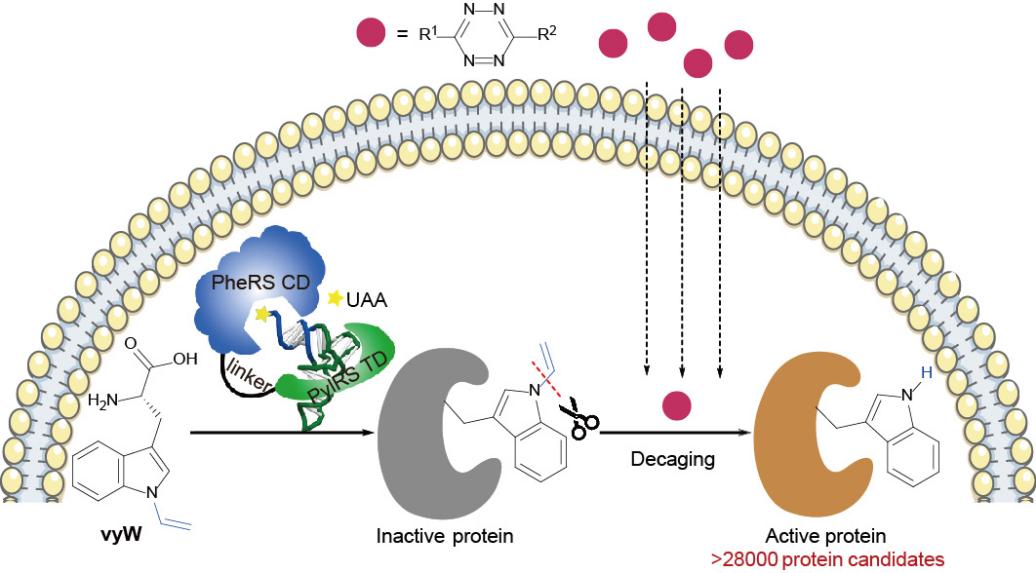
图1. 色氨酸脱笼策略示意图
在研究中,研究人员首先设计了能掩蔽几乎所有色氨酸相互作用的非天然氨基酸,并发展了与之配套的生物正交剪切反应。研究人员在色氨酸的吲哚氮原子上引入一个额外的π系统(乙烯基),通过共轭效应削弱了吲哚环的π能量,从而同时阻断了色氨酸的极性相互作用、疏水相互作用和π相互作用(图2)。此外,研究人员还注意到乙烯基的HOMO轨道能量因共轭作用而上升,使其参与逆电子需求的狄尔斯-阿尔德反应(IEDDA)的活性增强。基于这一发现,研究人员开发了首个针对吲哚类结构的IEDDA-剪切反应。该反应可在PBS溶液中稳定进行,能够在30分钟内以大于80%的收率得到脱笼产物。
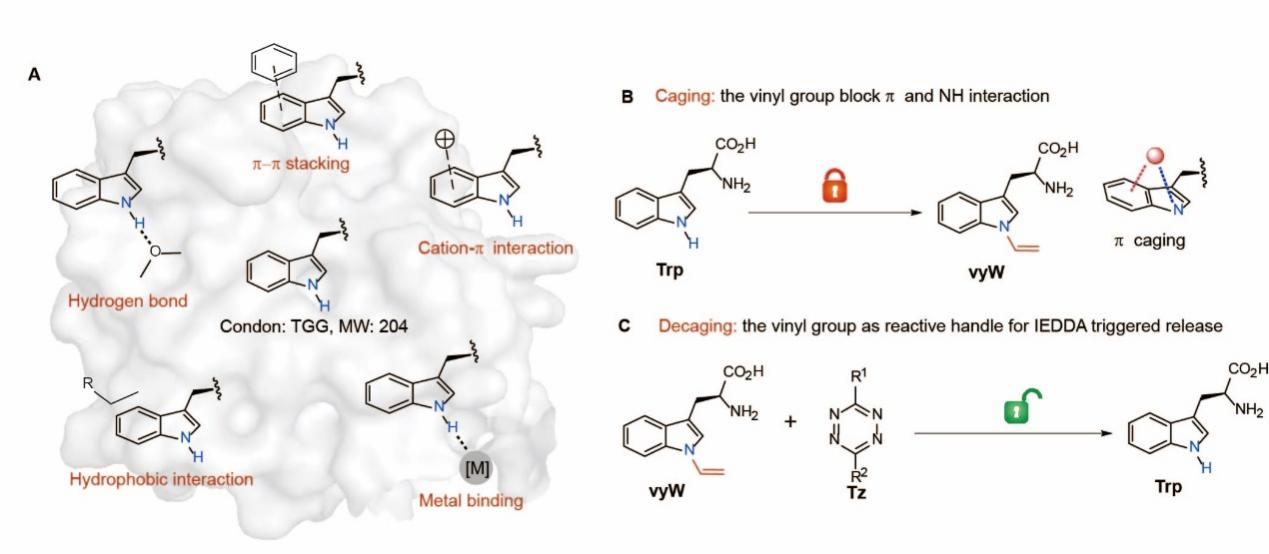
图2. 非天然氨基酸的设计及生物正交剪切反应的发展
接下来,研究人员采用了遗传密码子扩展策略以位点特异性的方式将“笼锁”色氨酸(N-乙烯基色氨酸,vyW)引入蛋白质中,并采用了“级联进化”的策略对嵌合体苯丙氨酸氨酰-tRNA合成酶(chPheRS)加以进化筛选[4]。首先,他们选择了一种与vyW化学结构相似且只相差一个碳原子的过渡化合物N-甲基色氨酸(1MW)。通过定向进化筛选,成功获得了能够识别1MW的突变体(1MWRS),并建立了1MW和vyW与这些突变体之间的对接模型。基于对接模型的不同,研究人员有针对性地对1MWRS进行了三个关键残基的突变,并最终成功鉴定出一种高效准确识别vyW的氨酰-tRNA合成酶(vyWRS)(图3)。随后,研究者们利用模型蛋白质在体外以及活细胞中评估了脱笼反应的效率。实验结果显示,对于体外纯化的模型蛋白质-GFP上的vyW,其脱笼效率可超过>90%,而在活细胞中,使用Renilla Luciferase (RLuc) 报告系统评估的脱笼效率达到了54%。

图3. 氨酰合成酶-tRNA的进化
在此基础上,研究人员建立了蛋白质激活的通用平台。通过在PDB数据库中使用新建的算法来搜索含有关键色氨酸的蛋白质,发现超过28,000个蛋白质的色氨酸-配体距离在5 Å以内。这表明这些蛋白质可以通过色氨酸脱笼技术进行功能研究。色氨酸残基在蛋白质中的化学相互作用可以归类为五种主要类型,包括氢键作用、疏水相互作用、金属结合、π-π堆积和阳离子-π相互作用。研究人员针对每种相互作用挑选了示例蛋白,并成功使用Trp-CAGE策略“沉默”和“恢复”了相应的蛋白质功能。Trp-CAGE策略的应用范围广泛,可以精确调控多种蛋白质的生理过程,包括别构作用、蛋白质成熟过程、酶活口袋调控,蛋白质-RNA相互作用以及蛋白质-蛋白质相互作用等。该策略适用于各种蛋白质家族,包括荧光蛋白(用于生物标记和显微镜研究)、金属结合蛋白(参与金属离子的配位和催化反应)、激酶(调控信号传导通路)、荧光素酶(用于生物发光实验)、翻译起始因子(调节蛋白质合成)和翻译后修饰读取蛋白(参与蛋白质修饰)等。通过Trp-CAGE策略,这些蛋白质的功能可以被精准的调控和研究。
总结
综上,该工作发展了一种独特且通用的色氨酸脱笼方法,用于“化学”激活蛋白质特定位点上的色氨酸,以实现相应蛋白质的功能获得性研究。该工作首次实现了对活细胞中π相互作用的调控,是生物正交剪切反应领域的全新突破。
北京大学博士后朱玉超、浙江大学博士后丁文龙为论文的共同第一作者,陈鹏教授、林世贤研究员和樊新元副研究员为论文的共同通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Genetically encoded bioorthogonal tryptophan decaging in living cells
Yuchao Zhu,# Wenlong Ding,# Yulin Chen, Ye Shan, Chao Liu, Xinyuan Fan,* Shixian Lin* & Peng R. Chen*
Nat. Chem., 2024, DOI:10.1038/s41557-024-01463-7
生物正交剪切反应与蛋白质脱笼工具箱简介
近年来,活细胞化学反应取得了多项重要进展,其中包括获得2022年诺贝尔化学奖的“点击化学”(2001年)和“生物正交化学”(2003年)[5-6]。以CuAAC反应,SPAAC反应以及iEDDA反应为代表的快速、特异的连接反应允许研究人员原位、定点、迅速地对蛋白进行标记,不仅丰富了细胞内蛋白质功能的研究工具,还促进了相关治疗方案的发展。
相比于形成化学键的经典的“生物正交偶联”反应,旨在切断化学键的“生物正交剪切”反应在过去的十年里掀起了新的浪潮,从相反的维度拓展了活细胞化学。“生物正交剪切反应”的概念由北京大学陈鹏课题组在国际上首次提出 [7],并首次应用到了赖氨酸(Lys)的蛋白质脱笼中。经过近十年的发展,陈鹏课题组已经搭建了覆盖多种关键氨基酸残基,空间上从亚细胞到活体动物,时间上精准到秒级的多功能蛋白质脱笼平台。本文将对陈鹏课题组利用“生物正交剪切反应”构建“蛋白质脱笼”工具箱的相关工作做一概述。
蛋白质脱笼技术的原理
蛋白质脱笼技术基于生物正交剪切反应与遗传密码子扩增技术的结合(图4)。研究人员通过基因密码子扩展技术在目标蛋白质中引入“笼锁”氨基酸(Caged amino acid),该笼锁形式可暂时掩蔽蛋白质的功能。随后,通过可在活细胞内发生的生物正交剪切反应进行“脱笼解锁”, 可以在活细胞环境中原位、特异地激活特定蛋白质。这一技术为在活细胞中原位调控、研究蛋白质的功能提供了强大的武器。

图4. 蛋白质脱笼策略示意图
金属钯引发的生物正交赖氨酸脱笼
2014年,陈鹏课题组在Nature Chemistry(Nat. Chem. 2014, 352-361)报道了金属钯引发的生物正交赖氨酸脱笼技术。研究人员设计合成了炔丙氧羰基保护的赖氨酸 (ProcK),并通过遗传密码子扩展技术将其引入目标蛋白质上关键活性位点,实现对蛋白的活性抑制,再利用钯介导的生物正交剪切技术,脱除炔丙氧羰基,在活细胞内实现了氨基酸侧链残基的原位释放,进而恢复蛋白的活性。借助该策略,陈鹏课题组在哺乳动物细胞中实现了OspF的原位激活。随后的跟踪实验显示,这一操作导致其下游底物ERK发生了不可逆去磷酸化,最终导致ERK无法重新进入细胞核,在细胞质中出现积聚(图5)。这一工作的发表也正式标志着蛋白质脱笼技术进入“正交时代”(Bioorthogonal Era)。
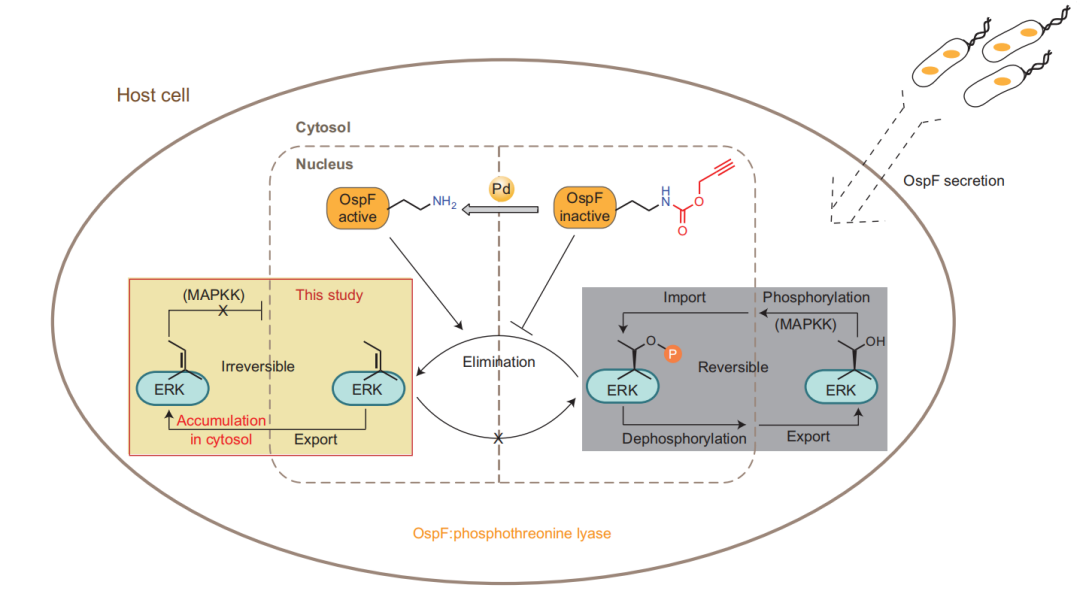
图5. 小分子 Pd 介导的活细胞内赖氨酸依赖蛋白酶的激活
钯引发的连烯脱除反应用于酪氨酸脱笼
2016年,陈鹏课题组利用钯催化剂促进的连烯脱除反应开发了活细胞内的酪氨酸脱笼方法(J. Am. Chem. Soc. 2016, 138, 15118);通过筛选出适合的钯催化剂和酚羟基的保护基,设计合成了非天然酪氨酸 (AlleY),并通过定向进化获得可以识别该非天然氨基酸的tRNA合成酶,再将AlleY插入目标蛋白后,可以高效实现酪氨酸为活性位点的蛋白酶的活性释放。并进一步将其应用于激酶Src 的Y416 特异性磷酸化调控以及炭疽病毒致死因子(Lethal Factor)的活性调控(图6)。
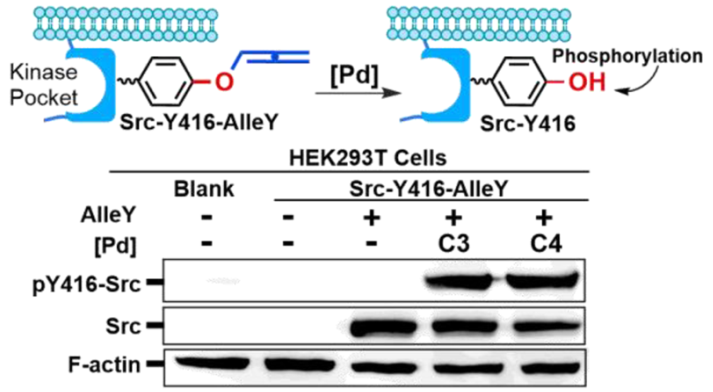
图6. 金属 Pd 介导活细胞内酪氨酸依赖蛋白酶的激活
金属铜引发的“分子内剪切”脱笼技术
相对于在生物正交偶联化学中大放异彩的 CuAAC 反应,对于过渡金属 Cu 介导的生物正交剪切技术却有待开发。2019年,陈鹏课题组与合作者发展了双取代炔丙基/铜试剂促进的分子内剪切反应,并结合非天然氨基酸定点插入技术实现了细胞膜表面受体-配体相互作用的原位调控(J. Am. Chem. Soc. 2019, 141, 17133,图7)。研究人员设计并制备了基于氨基和酚羟基的可控释放型抗体偶联药物(Cleavable ADCs),成功实现了对癌细胞的选择性杀伤。同时,该分子内剪切反应还被用于细胞表面的可逆修饰,进一步突破了传统化学脱笼的瓶颈,为生物大分子功能及活性调控提供了普适性工具。
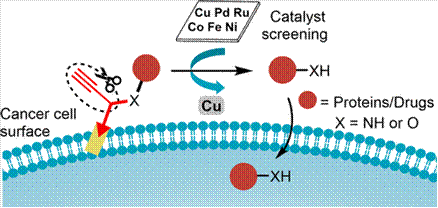
图7. 金属 Cu 介导的“分子内剪切”促进生物大分子的活性可控释放
基于四嗪引发的反式环辛烯生物正交剪切反应的赖氨酸脱笼
为了提高激活的速率以及消除钯催化剂潜在的重金属毒性问题,陈鹏课题组借助四嗪引发的反式环辛烯生物正交剪切反应,设计了反式环辛烯保护的赖氨酸 (TCOK),并通过遗传密码子扩展技术将其成功插入目标蛋白用以合成失活的前体蛋白,并且验证了在加入四嗪分子 Tz 后可以在很短的时间内将前体蛋白激活(图8)。这一生物正交剪切反应的最大优势在于反应速率快和效率高,同时还有很高的生物相容性。通过理性的设计和对反应的优化,可以在几分钟的时间尺度上激活细胞内的酶(Nat. Chem. Biol. 2014, 10, 1003)。这一工作是化学小分子引发蛋白脱笼的首次报道。

图8. 基于小分子四嗪介导的剪切化学用于活细胞的蛋白酶激活
活体动物里的蛋白质脱笼
2016年,基于四嗪分子和反式环辛烯反应良好的生物正交性和快速高效的特点,陈鹏课题组将蛋白质脱笼拓展到了活体动物层面。通过小鼠尾静脉注射小分子激活剂,实现了在异种移植的部位激活激酶(图9)。该方法实际上展示的是一种通用的激酶激活方法,同时还实现了在活体动物的复杂环境下激活激酶,将小分子介导的酶激活方法拓展到了一个全新的高度(ACS Cent. Sci. 2016, 2, 325)。
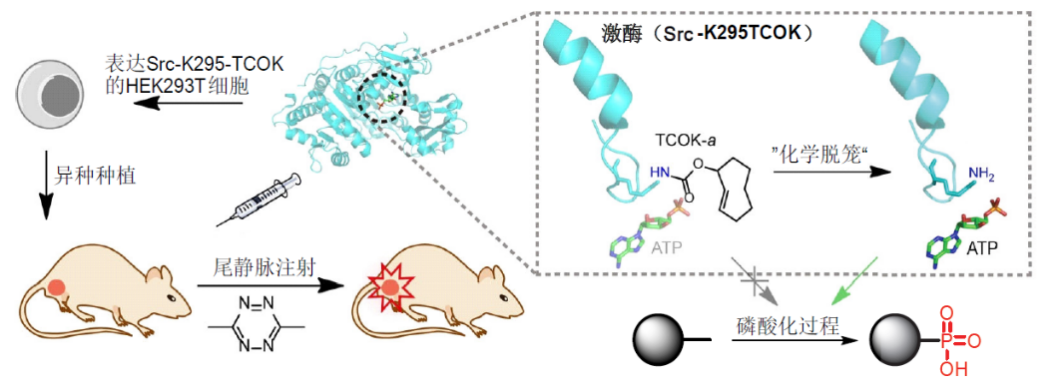
图9. 基于小分子四嗪介导的剪切化学用于活体动物的激酶激活
非特定残基依赖的“邻近脱笼”技术
由于细胞内蛋白质的种类繁多、活性调控机制各异,目前该方法仍受可供脱笼的氨基酸种类限制,无法适用于所有蛋白质。为了解决这一瓶颈问题,2019年,陈鹏课题组与王初课题组合作,发展了“邻近脱笼”的新策略(Nature, 2019, 569, 509)。通过向蛋白质活性中心附近引入带有光保护基团的非天然酪氨酸, 可实现对其活性的远程干扰和抑制;随后通过“光脱笼”反应将保护基团移除,使其活性重新恢复(图10)。由于在蛋白质活性口袋附近插入非天然氨基酸后能够通过影响蛋白稳定性、底物结合等多种因素调控蛋白质活性,该策略将原有的“活性位点脱笼”转变为“活性口袋脱笼”,极大地扩展了该方法的适用范围。并借助计算机辅助的蛋白质结构设计,对目标蛋白中可以插入ONBY的合适邻近位点进行了系统地虚拟筛选,通过计算其所处位置的几何参数以及对蛋白质结构影响的能量参数选出合适推荐的位点供实验验证。并分别在荧光素酶、GTP水解酶、RNA去甲基化酶FTO、蛋白激酶、caspase细胞凋亡蛋白酶和炭疽致死因子(lethal factor)金属蛋白酶等一系列不同类型的蛋白上展示了该瞬时激活方法在活体环境下的普适性。以及进一步利用CAGE-prox建立了活细胞内的激酶正交激活和信号转导系统,完成了细胞凋亡蛋白酶的瞬时激活和酶切底物的组学鉴定,并通过激活细菌毒素蛋白(炭疽致死因子)开发了抗肿瘤蛋白质前药的治疗策略。
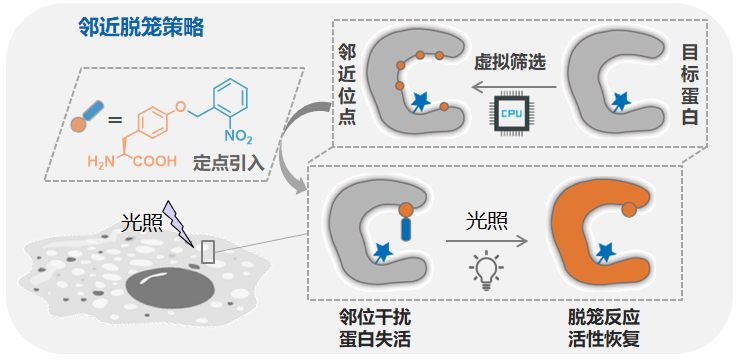
图10. 非特定残基依赖的邻近脱笼技术
酸性氨基酸的脱笼
尽管蛋白质脱笼已经成为在活体环境下精确操控生物大分子功能的有效方法,并在赖氨酸、半胱氨酸、酪氨酸、丝氨酸实现了脱笼化学的开发,但针对酸性氨基酸的脱笼化学仍是领域内的一大挑战。2023年,陈鹏课题组发展了对天冬氨酸的脱笼策略,并通过计算辅助定向进化对吡咯赖氨酸氨酰tRNA合成酶(PylRS)进行了改造,识别了相应的非天然氨基酸,从而实现了对蛋白质功能的控制。该工作实现了在目的蛋白中原位和瞬时释放Asp残基,为活细胞脱笼化学工具箱又增添一位重要的成员(JACS, 2023, 145, 19218,图11)。几乎与此同时,北京大学药学院刘涛课题组(CCS Chem. 2023, 5, 1301)和天津大学轩维民课题组(Angew. 2023, 62, e202308472)报道了另一种酸性氨基酸—谷氨酸的脱笼,这两种脱笼技术共同解决了酸性氨基酸脱笼的难题。

图11. 天冬氨酸光脱笼技术
蛋白质脱笼的时间分辨率推进到“秒级”
2024年,陈鹏课题组和南方科技大学田瑞军课题组合作报道了一种基于生物正交脱笼和蛋白质组学策略的活细胞激酶“脉冲追踪”技术(DeKinomics),实现了高时间分辨的激酶信号转导原位解析(Nat. Chem. Biol., 2024, DOI: 10.1038/s41589-023-01497-x)。该技术将蛋白质脱笼的时间分辨率提升到了“秒级”。在Dekinomics技术中,通过“遗传密码子扩展+生物正交剪切反应”的化学生物学策略,在目标激酶的活性赖氨酸位点定点插入ONP保护的赖氨酸衍生物ONPK,笼蔽激酶活性;随后利用高时间分辨的紫外光照脱除ONP保护基团,释放赖氨酸的侧链氨基,实现激酶的特异性激活;在目标激酶激活后数秒至数分钟内,固定和捕捉细胞磷酸化图景,开展磷酸化蛋白质组学分析,精准揭示激酶下游信号通路响应的时间信息(图12)。该工作揭示了UBA1活性调控的新机制,而且提示了酪氨酸磷酸化和泛素化在修饰酶层面串扰(crosstalk)的新机制:泛素化介导的激酶降解是一种激酶活性的负反馈调节机制,这一机制所依赖的泛素化能够被SRC介导的UBA1酪氨酸磷酸化所抑制。
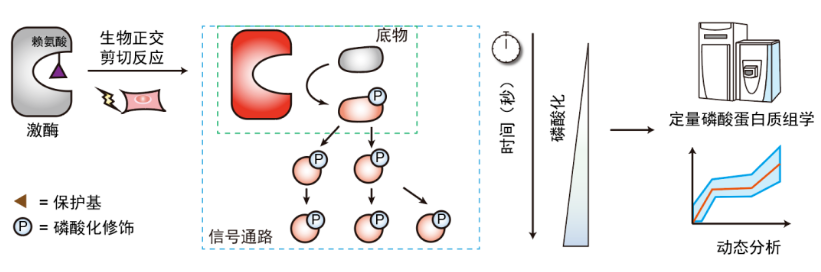
图12. 分辨率达到“秒级”的活细胞激酶激活
经过近十年的发展,基于生物正交剪切反应的蛋白质脱笼技术已经形成了一套功能强大的“工具箱”。在时间尺度上,蛋白质脱笼的分辨率已经被推进到了秒级;在空间尺度上,已经在亚细胞到活体动物的多尺度上实现了脱笼。非特定残基依赖的“邻近脱笼”技术也被开发出来。最新报道的“色氨酸脱笼”首次实现了对活细胞中π相互作用的调控,是生物正交剪切反应领域的全新突破。
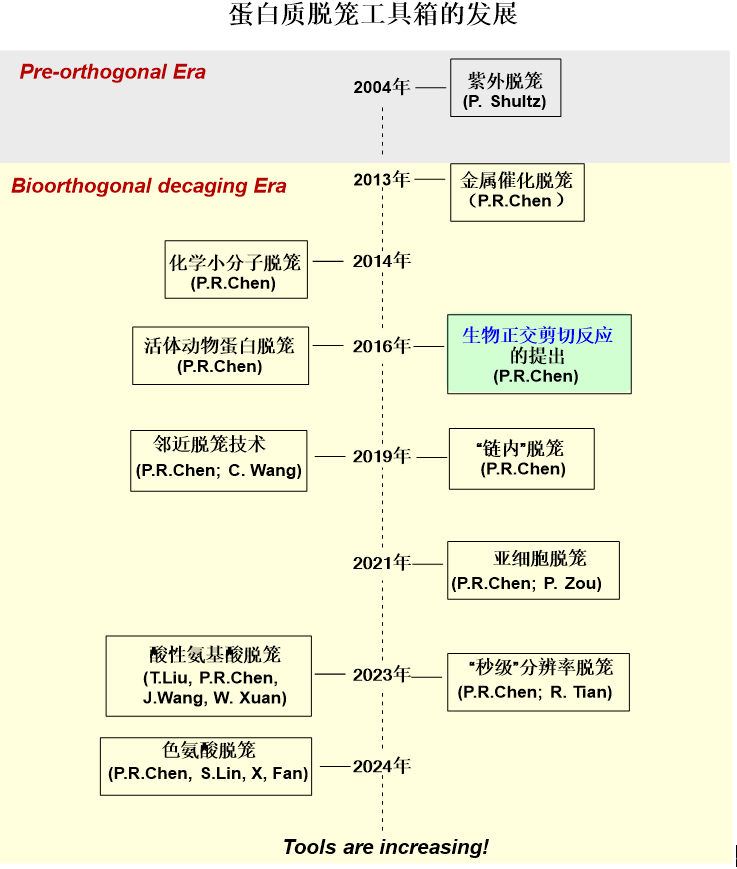
图13. 蛋白质脱笼工具箱的发展脉络
如今,陈鹏课题组的蛋白质脱笼“工具箱”已覆盖多种关键氨基酸,可脱笼氨基酸的种类还在增长当中。随着氨基酸脱笼技术的日益丰富和广泛应用,我们可以期待它在未来科学研究中扮演更为重要的角色,揭示更多有关生命的奥秘。
参考文献:
1. Barik, S. The Uniqueness of Tryptophan in Biology: Properties, Metabolism, Interactions and Localization in Proteins. Int. J. Mol. Sci. 21, 8776, (2020).
2. Cuello, L. G. et al. Structural basis for the coupling between activation and inactivation gates in K+ channels. Nature 466, 272-275, (2010).
3. Xue, Y. et al. Cu(I) recognition via cation-π and methionine interactions in CusF. Nat. Chem. Biol. 4, 107-109, (2007).
4. Ding, W. et al. Chimeric design of pyrrolysyl-tRNA synthetase/tRNA pairs and canonical synthetase/tRNA pairs for genetic code expansion. Nat. Commun. 11, 3154, (2020).
5. Kolb, H.C., Finn, M.G. & Sharpless, K.B. Click chemistry: diverse chemical function from a few good reactions. Angew. Chem. Int. Ed. Engl. 40, 2004–2021 (2001).
6. Hang, H.C., Yu, C., Kato, D.L. & Bertozzi, C.R. A metabolic labeling approach toward proteomic analysis of mucin-type O-linked glycosylation. Proc. Natl. Acad. Sci. USA 100, 14846–14851 (2003)
7. Li, J. & Chen, P. R. Development and application of bond cleavage reactions in bioorthogonal chemistry. Nat. Chem. Biol. 12, 129-137, (2016)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号