JACS:核酸适配体介导的肿瘤迁移抑制领域新进展
肿瘤的侵袭和转移过程是肿瘤发展的主要因素,也是癌症患者死亡的主要原因。在肿瘤的迁移过程中,有许多与肿瘤发生发展密切相关的蛋白参了该过程并起到非常重要的作用。因此,研究肿瘤发生发展过程中与癌细胞迁移密切相关的蛋白对开发新的治疗方法、指导临床治疗具有重要意义。
袁荃/杨雁冰团队基于适配体疗法的作用机制,提出了一种基于阻断癌细胞信号通路的核酸适配体抑制剂阻断蛋白质功能的药理学机制,用于阻碍癌细胞的迁移。该研究提出的具有单一靶向实现多重信号通路抑制的核酸适配体为癌症的治疗提供了新的思路,为阻碍肿瘤的发生、发展过程提供了新的指导思想。

图1. CKAP4靶向的适配体通过调节整合素相关的细胞粘附和PI3K/AKT信号通路抑制肿瘤转移和进展
细胞骨架相关蛋白4(CKAP4)是一种在多种癌细胞中过度表达的跨膜蛋白,CKAP4参与调节癌细胞粘附功能,并在癌细胞迁移相关的信号通路中扮演了重要角色。CKAP4参与α5β1整合素的内化和运输过程,调节纤维连接素依赖的细胞粘附能力变化。此外,CKAP4与分泌蛋白DKK1结合激活磷酸肌醇3激酶(PI3K)-AKT信号通路,调控骨架蛋白的重组并促进细胞迁移过程。考虑到CKAP4在肿瘤中迁移中的多重促进作用,CKAP4犹如肿瘤发生发展进程当中的“潘多拉魔盒”,是肿瘤的一个重要治疗靶点。以与癌症迁移密切相关的蛋白CAKP4为研究对象,开发新的治疗方法对于指导临床治疗具有重要意义。
核酸适配体,通常被称为化学抗体,其具有高度的特异性和亲和力、低免疫原性、可重复制造和快速渗透组织的能力,在药理开发中具有巨大的潜力。在该工作中,研究团队基于适配体疗法的作用机制,提出了适配体抑制剂阻断蛋白质功能的药理学机制,开发了以CKAP4为靶点的适配体抑制剂疗法。该研究发现了CKAP4适配体会干扰CKAP4与配体整合素β1和配体DKK1的相互作用,不仅影响α5β1整合素介导细胞粘附功能,削弱细胞转移中的牵引力,还抑制CKAP4/DKK1启动PI3K/AKT信号通路,阻碍该信号通路调控的细胞骨架重组过程,抑制了癌细胞的迁移与侵袭行为(如图1所示)。该研究为癌症的治疗提供了新的思路,为阻碍肿瘤的发生、发展过程提供了新的指导思想。
研究团队通过采用划痕实验、跨孔迁移和Transwell侵袭实验来研究CKAP4核酸适配体与肿瘤细胞结合后对肿瘤细胞的行为的影响(图2)。在测量细胞运动性的划痕伤口测试中,观察到在划痕24 h和36 h后,适配体处理后的癌细胞相较于对照组表现出更明显的伤口间隙,表明适配体刺激阻碍了癌细胞的运动;在扩孔迁移实验中,观察到在适配体的影响下,跨孔迁移的癌细胞数目明显减少,穿过基质胶的癌细胞数目也降低,表明CKAP4核酸适配体能够影响癌细胞迁移和侵袭,对细胞的运动行为起到了明显的阻碍作用。
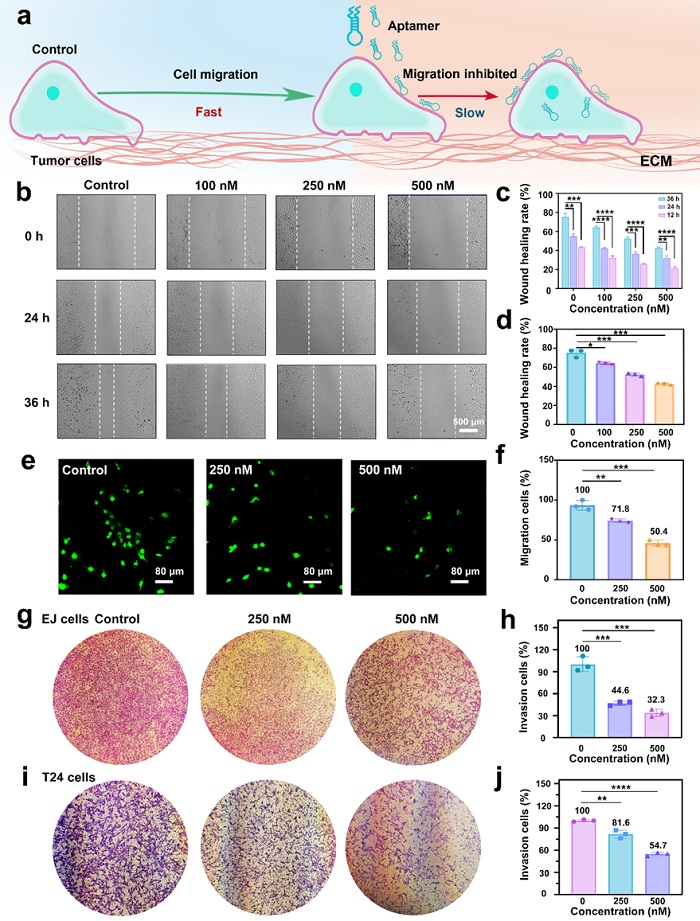
图2. CKAP4核酸适配体抑制肿瘤细胞的迁移和侵袭
细胞迁移是一种复杂的细胞行为,涉及细胞前部的突出和粘附以及后部的收缩和分离。整合素转运对于整合素依赖的细胞粘附、扩散、迁移和癌细胞侵袭很重要。α5β1整合素已被证明会增强侵袭性癌细胞的迁移。CKAP4能够与整合素β1结合,通过参与α5β1整合素的转运来调节细胞粘附和迁移。研究团队进行了免疫沉淀、蛋白质印迹和细胞黏附实验来探究CKAP4核酸适配体是否会抑制CKAP4与整合素之间的相互作用以及相关的信号调节过程。实验结果表明CKAP4核酸适配体与细胞上的CKAP4结合后,能够明显的抑制CKAP4与β1整合素的结合,阻碍整合素内化和循环过程,导致细胞-细胞之间和细胞与基质之间的粘附作用变化,削弱细胞迁移的驱动力,从而抑制了癌细胞的迁移(图3)。
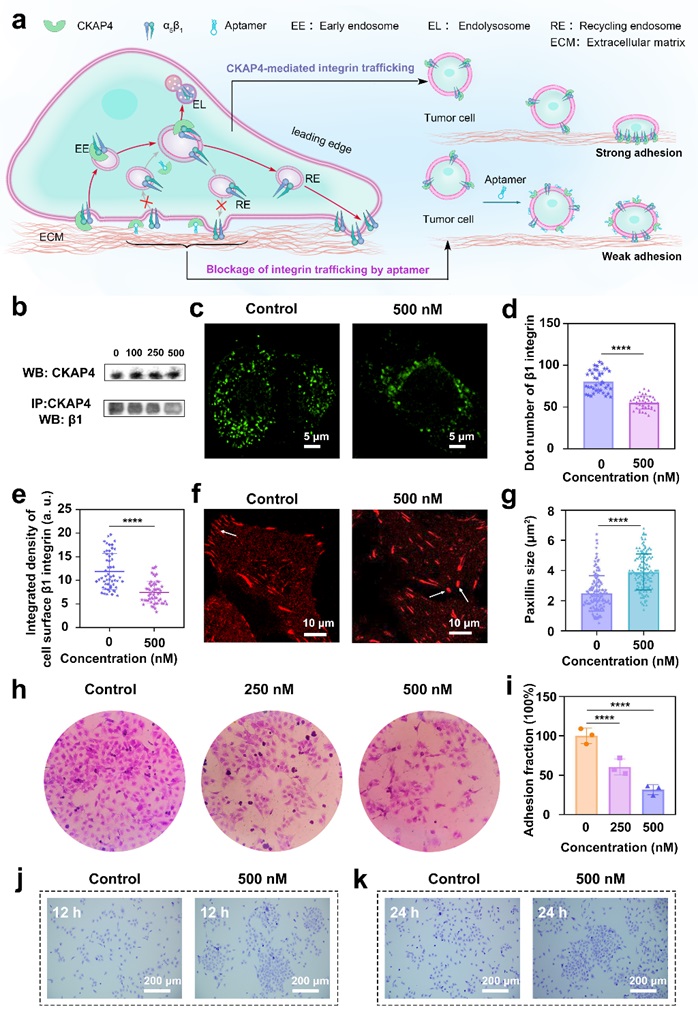
图3. 适配体阻碍了CKAP4参与整合素的转运并调节细胞粘附
CKAP4除了参与α5β1整合素的内化和循环过程之外,还参与了调节细胞生长、细胞周期进程、蛋白质翻译和代谢的磷脂酰肌醇-3激酶/Akt(PI3K/Akt)信号通路。分泌蛋白Dickkopf-1(DKK-1)是PI3K/Akt信号通路的重要受体蛋白,CKAP4是DKK-1的配体,二者结合会激活PI3K/Akt信号传导并刺激细胞的粘附、迁移和增殖等行为。研究团队采用免疫沉淀、免疫印迹、共聚焦和超分辨成像实验来研究核酸适配体对CKAP4与DKK1相互作用的影响以及对PI3K/AKT信号通路的影响。实验结果表明,核酸适配体会影响CKAP4/DKK1的相互作用,从而使其下游的p-AKT/AKT的含量减少,影响PI3K/AKT信号的传导。PI3K/AKT信号通路减弱,会影响细胞迁移过程中的骨架的重组行为,削弱了细胞的迁移能力(图4)。
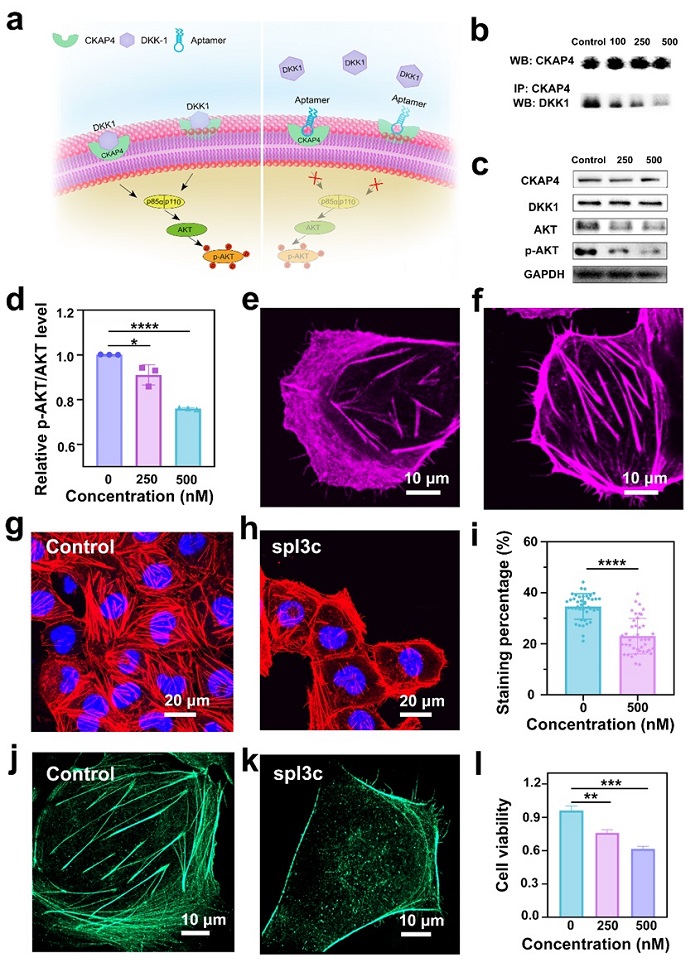
图4. 适配体阻碍CKAP4与DKK1的相互作用并影响PI3K/AKT信号通路的传导
综上,作者在本工作中提出了一种基于阻断癌细胞信号通路的核酸适配体来抑制细胞的迁移行为。以与癌症迁移密切相关的蛋白CAKP4为研究对象,发现了其适配体会干扰CKAP4与配体整合素β1和配体DKK1的相互作用,不仅影响α5β1整合素介导细胞粘附功能,削弱细胞转移中的牵引力,还抑制CKAP4/DKK1启动的PI3K/AKT信号通路,阻碍该信号通路调控的细胞骨架重组过程,抑制了癌细胞的迁移与侵袭行为。本工作促进了肿瘤的发生发展分子机理研究,为肿瘤的靶向治疗提供了新思路。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Regulation of Cellular Signaling with an Aptamer Inhibitor to Impede Cancer Metastasis
Yurong Wei, Shiyi Long, Min Zhao, Jingfang Zhao, Yun Zhang, Wang He, Limin Xiang, Jie Tan, Mao Ye, Weihong Tan, Yanbing Yang*, Quan Yuan*
J. Am. Chem. Soc., 2023, DOI: 10.1021/jacs.3c09091
导师介绍
袁荃
https://www.x-mol.com/university/faculty/66357
杨雁冰
https://www.x-mol.com/university/faculty/336736
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号