浙工大葛璟燕课题组JACS:IGF2融合溶酶体靶向嵌合体iLYTAC
近期,浙江工业大学生物工程学院葛璟燕课题组、新加坡国立大学Yao Shao Q.教授、大连理工大学都书博教授联合开发了基于IGF2融合蛋白的溶酶体靶向蛋白降解新技术iLYTAC。相关成果发表于权威期刊Journal of the American Chemical Society。
靶向蛋白降解(Targeted Protein Degradation, TPD)技术是目前药物研究领域中备受瞩目的新兴技术之一。它突破了传统小分子需强结合位点的需求,可有效靶向降解一些传统抑制剂“不可成药”的靶点。诺贝尔奖得主Bertozzi课题组在2020年首次提出多糖构建的溶酶体靶向嵌合体(LYTAC),为40%的胞外蛋白的降解开辟了道路。随后,许多研究团队相继开发了一系列基于细胞内吞-溶酶体机制的膜蛋白降解策略,在靶向各种“不可成药”蛋白上展现出巨大的潜力,然而,内吞受体的配体多是外源物,糖类合成、抗体工程复杂,稳定性也有待提高。
LYTAC的溶酶体靶向受体(LTR)是CI-M6PR,也被称为胰岛素样生长因子-2受体(IGF2R),不仅可识别甘露糖-6-磷酸(M6P),也可以与胰岛素样生长因子2(IGF2),并以高亲和力结合,进入溶酶体,从而维持IGF2的水平。本文基于此现象,课题组利用IGF2作为LTR(IGF2R)的配体,构建了两类IGF2融合的重组蛋白iLYTACs,且成功展示其降解细胞外和细胞膜上蛋白的能力,包括表皮生长因子受体酪氨酸激酶(EGFR)、程序性死亡配体1(PD-L1)、α-突触核蛋白(α-Syn)和B淋巴细胞抗原CD20(图1)。
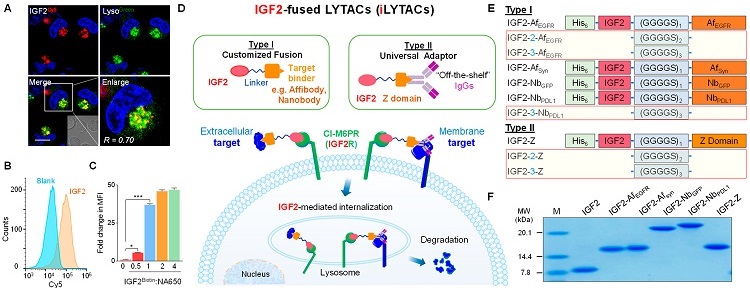
图1. iLYTAC技术用于膜蛋白靶向降解示意图
本文共设计并表达了四种I型iLYTAC(IGF2-AfEGFR、IGF2-AfSyn、IGF2-NbGFP及IGF2-NbPDL1)和II型iLYTAC(IGF2-Z)。其中,亲和体、纳米体具有尺寸小、稳定性和溶解度好、易生产、特异性高和免疫原性低等特性,是抗体的优秀替代品。所有蛋白均在大肠杆菌表达体系表达,且通过SDS-PAGE和质谱确定了蛋白纯度和大小。随后,利用荧光标记融合蛋白,通过细胞成像和流式细胞术验证iLYTAC能够被细胞摄取,且与溶酶体共定位。也通过生物膜干涉技术及细胞摄取实验研究了IGF2及iLYTAC的结合活性,结果也表明亲和体及纳米抗体的融合、不同的GGGGS的链长并没有对结合力产生很大影响。
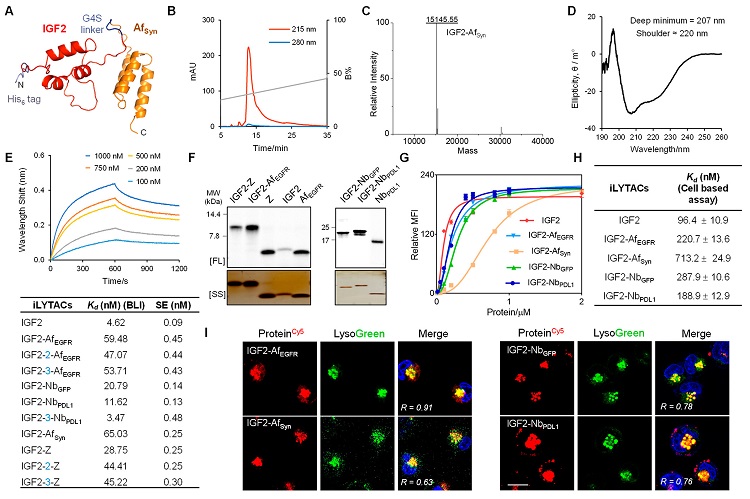
图2. iLYTAC的制备及表征
接下来,作者探索了I型iLYTACs对细胞膜上(EGFR\PD-L1)和细胞膜外(GFP\α-Syn)的降解效率。如,IGF2-AfEGFR处理后,EGFR在细胞膜上的EGFR转移到了细胞内,且WB结果显示,细胞中EGFR水平的降低呈现时间、浓度依赖(图3)。IGF2- fα-Syn对神经退行性疾病相关蛋白α-Syn也降解比较明显。
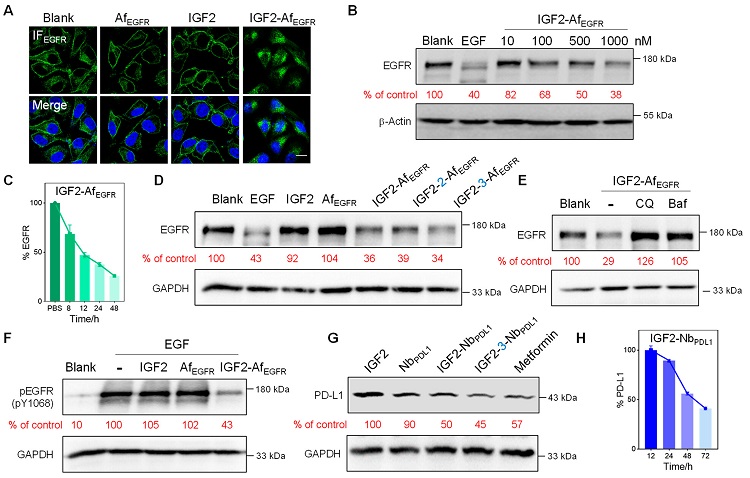
图3. I型iLYTAC的应用
而II型iLYTACs则是由IGF2与抗体恒定区Fc的结合的Z domain融合表达,可用于结合靶蛋白的IgG抗体(如已有的商业化抗体),具有普适性、可高通量筛选抗体药物等特性。同样以EGFR的单抗药物西妥昔单抗(Cet)为例,IGF2-Z能够将抗体带入到细胞中并定位溶酶体。WB结果也说明,Cet在与IGF2-Z联合给药时,能够降低细胞中EGFR的表达水平。

图4. II型iLYTAC的应用
最后,通过使用HeLa细胞裸鼠皮下移植瘤模型,评估了(IGF2-Z + Cet)和 IGF2-AfEGFR对治疗小鼠的抗肿瘤作用。以Cet、AfEGFR或IGF2-Z处理作为对照。IGF2-Z + Cet处理的小鼠肿瘤重量下降了近50%,而IGF2-AfEGFR处理的小鼠肿瘤重量变化较小。进一步WB分析肿瘤中EGFR表达水平,结果显示,肿瘤两类iLYTACs的处理能显著降低肿瘤中EGFR的水平。该研究结果也表明iLYTACs能够提升EGFR靶向耐药型肿瘤的治疗效果。
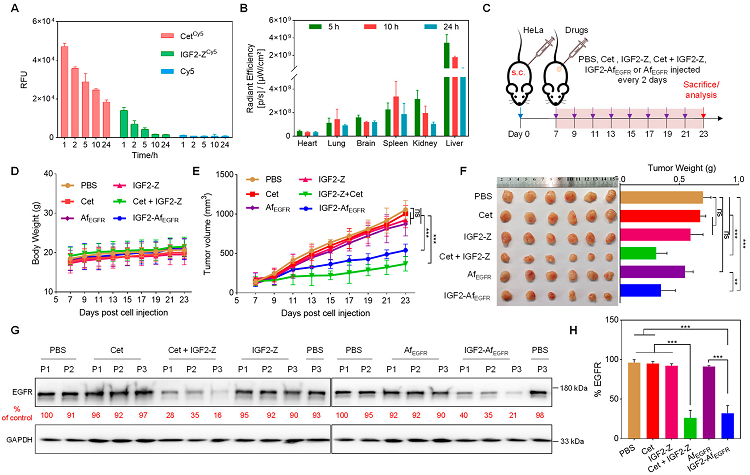
图5. 两类iLYTACs在肿瘤模型上的应用
总之,本文成功报道了重组嵌合IGF2融合蛋白,用于降解细胞外蛋白和膜蛋白。该策略便捷、有效、且可以通用化、模块化,为膜蛋白及膜外蛋白的药物开发、抗体药物的改善、耐药性的降低等等提供了强有力的工具,为重组蛋白类溶酶体靶向蛋白降解平台的设计开辟了新思路。当然,作者也提到一些相关缺点,如体内代谢快、降解周期相对长,仍需在后续工作中深化。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Insulin-like Growth Factor 2 (IGF2)-Fused Lysosomal Targeting Chimeras for Degradation of Extracellular and Membrane Proteins
Bei Zhang, Rajeev Kungur Brahma, Liquan Zhu, Jiayi Feng, Shiqi Hu, Linghui Qian, Shubo Du*, Shao Q. Yao*, and Jingyan Ge*
J. Am. Chem. Soc., 2023, 145, 24272–24283, DOI: 10.1021/jacs.3c08886
研究团队简介

葛璟燕,教授,博士生导师。先后毕业于浙江大学(本科)、新加坡国立大学(博士)。现为浙江工业大学生物工程学院教授。课题组近年来在Acc. Chem. Res.、J. Am. Chem. Soc.、ACS Cent. Sci.、ACS Chem. Biol.等国际知名期刊发表40余篇。入选浙江省“特聘专家”、浙江省中青年学科带头人、浙江省“高校领军人才培养计划”高层次拔尖人才。课题组专注于化学与生命科学的前沿交叉研究,着力构筑适用于“原位”研究蛋白质功能的分子工具,实现在分子层面上对蛋白质(组)的精准探测和调控。欢迎感兴趣的博士后和研究生联系并申请加入。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!













































 京公网安备 11010802027423号
京公网安备 11010802027423号