中科院大连化物所张丽华团队Angew:基于糖苷键质谱可碎裂交联剂的蛋白质复合物原位解析新技术
作为生命活动的执行者,蛋白质通过相互作用形成复合物等形式行使其特定的生物学功能,其中细胞内的限域效应、拥挤效应和细胞器微环境等对于维持蛋白质复合物结构和功能至关重要。化学交联技术(Chemical cross-linking mass spectrometry, CXMS),尤其是原位化学交联质谱技术(in-vivo CXMS)具有规模化分析蛋白复合物原位构象和相互作用界面的优势,已成为活细胞内蛋白质复合物解析的重要技术。然而,目前活细胞原位交联面临着细胞扰动大、交联肽段谱图复杂程度高等问题,因此如何实现活细胞低扰动下的原位快速交联是蛋白质原位构象和相互作用精准解析的先决条件。
中国科学院大连化学物理研究所张丽华研究员、赵群研究员团队长期致力于原位化学交联质谱新技术研究,通过研制新型多功能型化学交联剂(Anal. Chem., 2022, 94: 7551; Anal. Chem., 2022, 94: 12398; Anal. Chem., 2022, 94: 14143; Angew. Chem. Int. Ed., 2023, 62: e202215215),并建立深度覆盖的化学交联分析方法(Anal. Chem., 2020, 92: 1097; Front. Chem., 2022, 10: 994572; Anal. Chem., 2022, 94: 3904; Anal. Chem., 2023, 95: 6358)以及基于化学交联距离约束的蛋白质原位构象和相互作用解析方法(Anal. Chem., 2022, 94: 12051; Chem. Res. Chin. Univ., 2022, 38: 758)等,不断提升原位化学交联技术对于蛋白质复合物原位动态构象的深度捕获和精准分析能力。
近日,该团队基于糖分子的高生物兼容性和糖苷键的质谱可碎裂特征,将糖苷键引入到功能交联剂的骨架设计,筛选并获得了高生物兼容性的海藻糖作为骨架分子,成功研制了质谱可碎裂型交联剂-海藻糖二琥珀酰亚胺酯(TDS)。
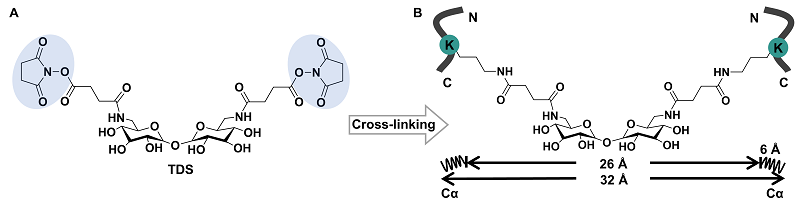
图1. TDS交联剂结构
与常规交联剂相比,TDS交联剂具有良好的两亲性和生物兼容性,在细胞交联过程中,无需引入DMSO等助溶试剂。采用台盼蓝染色和CCK-8考察交联剂维持细胞活性的能力,实验组中TDS交联半个小时后的细胞活性与PBS组没有显著性差异;较对照组中目前已报道的可透膜的可裂解型化学交联剂(质谱可碎裂型交联剂:DSSO、DSBU;化学可碎裂型交联剂:DSP等),展示了更加优异的细胞活性维持能力(91% vs 46%~76%);此外,蛋白质组学定量实验进一步证明了TDS在60分钟以内的活细胞原位交联过程中不会明显对蛋白质的表达量产生影响,因此实现了低扰动状态下细胞内蛋白质复合物的高效交联。
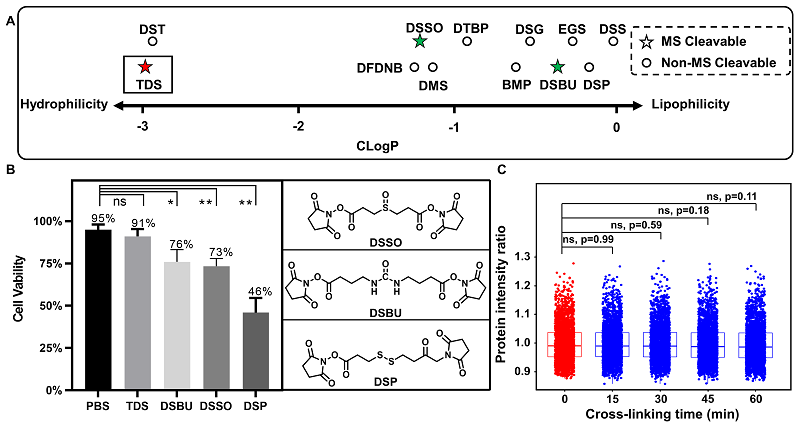
图2. TDS交联剂生物兼容性考察
进一步考察交联剂糖苷键的质谱碎裂模式,结果显示糖苷键在碰撞诱导解离(CID)和高能碰撞诱导解离(HCD)下均发生高效的碎裂,并产生两组对称的特征峰αL+βS和αS+βL,分别对应肽段的两种碎片离子(相差18 Da,即相差H(2)O(2))。同时,糖苷键碎裂所需质谱碰撞能量显著低于肽键,采用“高-低”台阶式碰撞模式,可以实现低能量状态下选择性碎裂糖苷键,而在高能量阶段碎裂肽键,从而实现特征峰和碎片离子的同时捕获,避免了常规采用耗时且复杂的MS2-MS3模式,有效提高了交联肽段的碎裂效率和质谱采集效率。
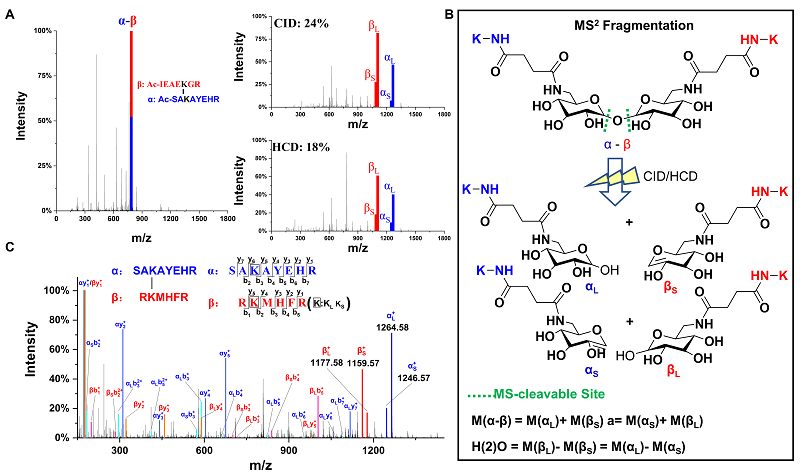
图3. TDS交联剂碎裂特性及碎裂机理
同时,基于TDS交联肽段质谱可碎裂特征,将常规“工字形”的交联肽段数据分析降幂为常规交联剂片段修饰的线性肽段数据检索模式,较DSS等不可碎裂型交联剂显著提高了交联肽段的鉴定通量和准确度。质谱可碎裂的TDS相较于不可碎裂型交联剂DSS和可碎裂型交联剂DSSO,具有更丰富的b/y离子和更低的干扰碎片离子,极大地降低了交联肽段谱图分析的复杂性,显著地提高了交联肽段的鉴定效率与准确度。
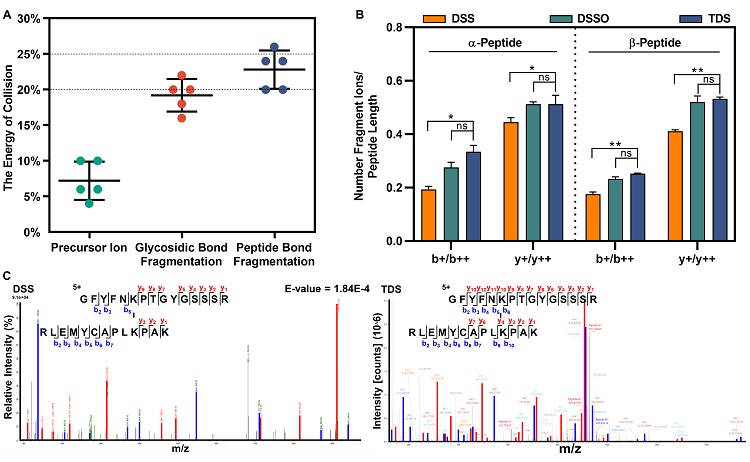
图4. TDS交联剂质谱采集行为
采用TDS交联剂分析酵母26S蛋白酶体,鉴定到971对交联肽,19S和20S亚复合体的覆盖程度分别达100% (19/19) 和86% (12/14),包括557对亚基内部和414个亚基间的交联信息,距离约束范围内的结构匹配度高达94%。并且,鉴定到了蛋白酶体四种不同的结构状态以及58种相互作用蛋白质,实现了蛋白酶体复合体的规模化组成、构象和互作位点分析。
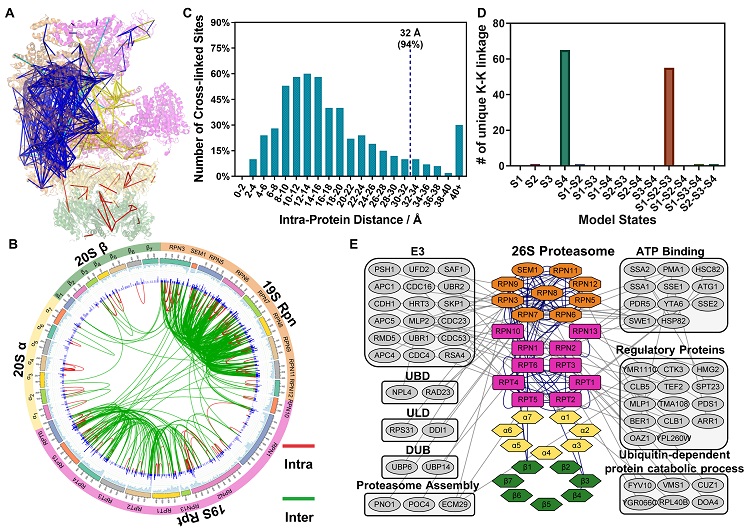
图5. 基于TDS交联剂的酵母26S蛋白酶体交联分析
在上述基础上,将其用于HeLa细胞内蛋白质复合物的原位交联与规模化分析,共鉴定到对应于3500对以上交联肽段,对应1453个蛋白质和843对蛋白质间的相互作用信息。鉴定到的蛋白广泛分布于细胞中的细胞质、线粒体和核仁等各种亚细胞器区域。其中,鉴定到的蛋白质间的相互作用67%被TRING数据库覆盖,42%的STRING Score≥0.9,表明基于TDS的原位交联-规模化解析策略显著提高了互作鉴定可信度,为活细胞中蛋白质互作网络的绘制以及功能调控的机制研究提供了重要的技术支撑和关键的结构位点信息。
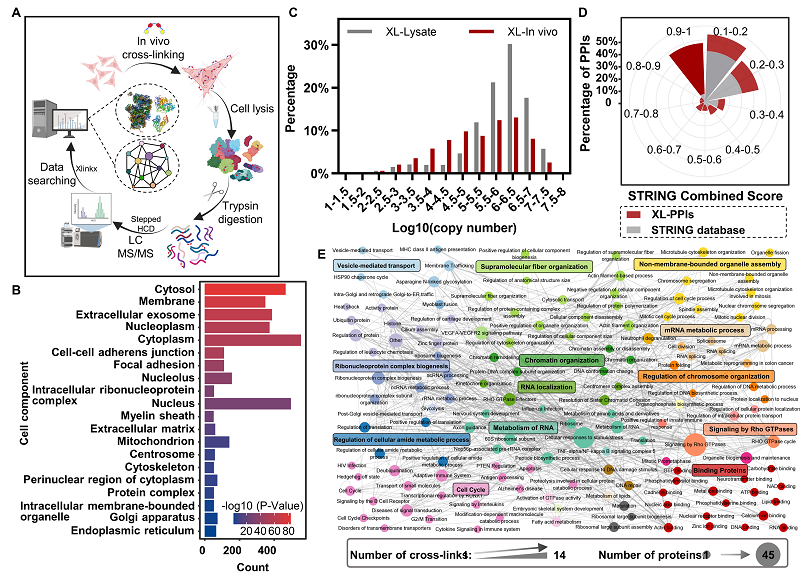
图6. TDS用于Hela细胞内蛋白质复合物的原位交联分析
综上,本文开发了一种基于糖苷键的高生物兼容性质谱可碎裂型交联剂—海藻糖二琥珀酰亚胺酯(TDS)。该交联剂糖苷键骨架的质谱可碎裂特征在增加了搜索通量的同时,还提高了交联鉴定的准确度及覆盖度。此外,由于TDS的高生物相容性和两亲性,使其实现了活细胞体内高效交联分析,为进一步提高化学交联技术对于细胞内蛋白质原位构象和相互作用的动态解析能力提供了重要的技术利器。
上述成果近日发表在《德国应用化学》(Angew. Chem. Int. Ed.)。该工作的通讯作者是大连化物所的张丽华研究员和赵群研究员,第一作者是大连化物所1810组博士研究生陈静。该工作得到了国家自然科学基金、国家重点研发计划、中科院青促会等项目的资助。
(文/图 陈静、赵群)
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A Glycosidic-Bond-Based Mass-Spectrometry-Cleavable Cross-linker Enables In vivo Cross-linking for Protein Complex Analysis
Jing Chen, Qun Zhao, Hang Gao, Lili Zhao, Huiying Chu, Yichu Shan, Zhen Liang, Yukui Zhang, Lihua Zhang
Angew. Chem. Int. Ed., 2023, DOI: 10.1002/anie.202212860
导师介绍
张丽华
https://www.x-mol.com/university/faculty/22784
课题组网站:
http://www.proteomics.dicp.ac.cn/
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号