浙大吴坚平、于浩然Angew:基于“突变景观”的LTA工程改造揭示遵循Prelog规则的碳-碳键不对称合成机制
L-苏氨酸醛缩酶(LTA)是一种磷酸吡哆醛(PLP)依赖酶,它能催化甘氨酸和醛生成多种具有两个手性中心的β-羟基-α-氨基酸。β-羟基-α-氨基酸是一类重要的手性中间体,广泛应用于制药领域,如氟苯尼考、氯霉素和屈昔多巴的合成。然而,野生LTA对β-羟基-α-氨基酸的β碳原子非对映体选择性低,阻碍了其工业化应用。

图1. L-苏氨酸醛缩酶催化合成β-羟基-α-氨基酸反应
近日,浙江大学化学工程与生物工程学院吴坚平教授和于浩然研究员在国际化学顶级期刊Angewandte Chemie International Edition发表论文,以Cellulosilyticum sp来源的L-苏氨酸醛缩酶(CpLTA)为研究对象,以催化对甲砜基苯甲醛(MTB)和甘氨酸(Gly)生成L-syn/anti-对甲砜基苯丝氨酸(L-syn/anti-MTPS)为模式反应,在突变景观(mutability landscape)的指导下使用CAST/ISM策略进行酶分子工程,实现了该酶非对映体选择性的提升和反转。获得的突变体H305L/Y8H/V143R对L-syn-MTPS的非对映体选择性从37.2%syn 提高至 99.4%syn。突变体H305Y/Y8I/W307E对L-anti-MTPS的非对映体选择性反转至97.2%anti。
作者首先使用CAVER3.0软件对CpLTA进行底物通道预测,发现该酶存在两个底物通道,命名为syn式通道和anti式通道(图2A)。然后对组成底物通道的13个关键氨基酸残基5K、6N、7D、8Y、30G、31Y、125T、126D、127E、142E、143V、305H和307W进行了定点饱和突变(图2C),构建了酶非对映体选择性和活性的突变景观图。综合分析发现Y8、Y31、V143、H305和W307等残基对L-苏氨酸醛缩酶的对映体选择性影响较大。随后使用CAST/ISM策略对这些位点进行了迭代饱和突变,最终获得了非对映体选择性提升和反转的突变组合。其中,突变体H305L/Y8H/V143R对L-syn-MTPS的非对映体选择性从37.2%syn 提高至 99.4%syn(图3);突变体H305Y/Y8I/W307E对L-anti-MTPS的非对映体选择性反转至97.2%anti(图3),酶活出现小幅度提升,从46.3 U/mg提高至54.2 U/mg。
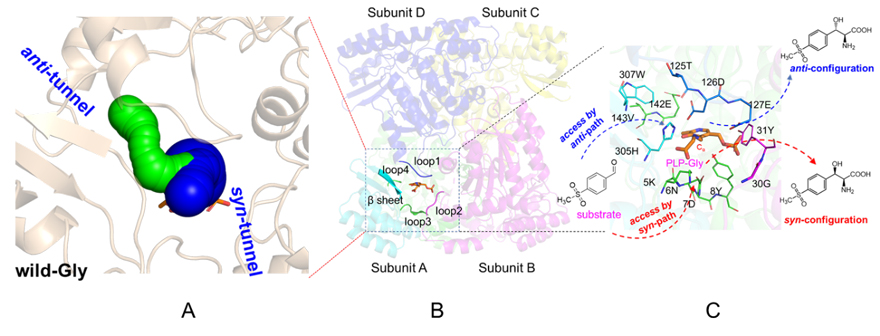
图2. CAVER3.0预测的底物通道
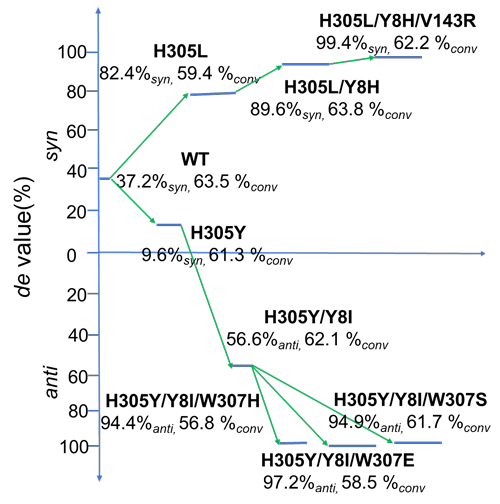
图3. 突变体的非对映体选择性
在进化过程中作者发现143号位残基与8号位残基存在上位效应(epistasis)。单独突变V143为R143不能提高CpLTA的非对映体选择性,但同时将Y8突变为G8、A8、C8、H8等残基时,组合突变体的非对映体选择性显著提高。此外,作者发现W307能够在anti式通道形成色氨酸门控,阻碍底物从anti通道进入活性中心,形成anti式产物。当W307突变为小位阻氨基酸残基时,CpLTA对anti式产物偏好性增强。同时,作者还发现8号位和307号位氨基酸残基具有较强的共进化关系,且共同调控LTA非对映体选择性。当8位和307位同时为Y和W时,LTA具有syn式构型产物偏好,而当8位和307位同时突变为其他氨基酸时,LTA具有anti式构型产物偏好。

图4. L-苏氨酸醛缩酶的非对映体选择性机理
作者随后进行了拉伸分子动力学模拟(multidirectional steered molecular dynamics),解析了该酶的底物进出双通道与非对映体选择性的关系。结果表明,底物从anti式通道进入活性中心时,形成anti式产物,而当底物从syn式通道进入活性中心时,形成syn式产物(图4A)。
最后,作者应用Prelog rule解释了LTA非对映体选择性的形成机理(图4B)。当Cα负离子的电子攻击底物醛re-face,形成anti式产物。相反,当Cα负离子的电子攻击底物醛的si-face,形成syn式产物。将Prelog规则应用于解释碳碳键的不对称合成是该文章的一大亮点。研究发现,路径假说和Prelog规则对指导转醛酶、转酮醇酶等催化碳-碳键不对称合成酶的立体选择性改造具有普适性。该研究为后续开发更多的碳-碳键不对称合成酶的非对映体选择性改造策略提供了理论基础,有助于推动生物催化碳碳键不对称合成的工业化应用。
论文第一作者为浙江大学杭州国际科创中心博士后郑文隆、蒲中机,共同通讯作者为浙江大学化学工程与生物工程学院吴坚平教授和于浩然研究员。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Mutability-Landscape-Guided Engineering of l-Threonine Aldolase Revealing the Prelog Rule in Mediating Diastereoselectivity of C-C Bond Formation
Wenlong Zheng, Zhongji Pu, Lanxin Xiao, Gang Xu, Lirong Yang, Haoran Yu, Jianping Wu
Angew. Chem. Int. Ed., 2022, DOI: 10.1002/anie.202213855
研究团队简介
吴坚平教授:浙江大学化学工程与生物工程学院教授,博士生导师。2000年获浙江大学生物化工专业博士学位,现任生物工程研究所所长,工业生物催化国家地方联合工程实验室副主任。主要研究方向为生物催化和转化、酶工程、生化反应工程以及可再生资源利用。
吴坚平教授长期致力于精细化学品的高效绿色生物制造,建立了生物催化制备精细化学品技术平台,已有多项技术成果实现产业应用,建成了国内首条全有机溶剂中酶催化反应制造手性农药的千吨级生产线和年产1万吨烟酰胺生产线,获得国家技术发明二等奖1项,省部级一等奖3项,为推动和促进生物催化在化工行业中的技术应用和产业转化做出了重要贡献。近年来在Angew. Chem. Int. Ed.,ACS Catalysis,Green Chemistry,Organic Letters、Advanced Synthesis & Catalysis等权威期刊发表高水平收录论文80余篇,获授权发明专利46项。
吴坚平-浙江大学个人主页:
https://person.zju.edu.cn/0000154#0
https://www.x-mol.com/university/faculty/21709
于浩然博士:浙江大学“百人计划”研究员,博士生导师,浙大杭州国际科创中心青年人才卓越计划入选者。本科、硕士毕业于天津大学,博士毕业于伦敦大学学院,归国前就职于伦敦大学学院任博士后研究员。主要研究领域包括蛋白质工程、酶分子设计等,在PNAS等期刊发表20余篇论文。主持国家自然科学基金青年项目、UCL-ZJU国际合作项目等,任英国皇家化学学会Associate member,中国生物工程学会合成生物学分会青年工作组委员等。
于浩然-浙江大学个人主页:
https://person.zju.edu.cn/yuhaoran
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!













































 京公网安备 11010802027423号
京公网安备 11010802027423号