Nat. Catal.:镍催化烯烃的对映选择性交叉偶联构建三/四取代立体中心
三取代和四取代立体中心是许多天然产物、药物分子和功能材料中的重要结构单元(图1a),并且这些中心周围原子的空间排列通常决定分子的形状,进而影响生物功能和毒性。目前,科学家通过不对称催化来精细控制三取代和四取代立体中心,该策略对药物化学和农业化学的研究至关重要。此外,利用过渡金属催化含碳官能团与前手性C-C π-骨架的多组分对映选择性偶联反应来构建含有立体中心且结构复杂的分子也是一种极具吸引力的途径,特别是Markovnikov选择性1,2-C-H键官能团化为控制立体化学提供了新的机遇,并且Pd 催化的还原性Heck型反应来构建 C(sp2)-C(sp3) 键也取得了开创性进展。近年来,科学家在非贵金属催化烯烃的对映选择性偶联方面取得了一些进展(图1b),而其中大多数是通过手性金属氢化物中间体I经加氢金属化/碳官能团化进行的,并且在加氢金属化(I→II)过程中决定对映选择性。另一方面,通过中间体III和IV结合两个含碳基团的转化也有报道,但是仅限于构建手性三芳基乙烷。尽管科学家在金属催化烯烃的对映选择性偶联方面做出了很多努力,但是仍存在一些问题(图1b):1)因空间位阻的影响仅限于构建三级立体中心;2)底物兼容性差(大多数为苯乙烯、N-酰基烯胺、芳基-1,3-二烯等),并且烯醇醚、N-乙烯基杂芳烃或乙烯基硅烷的反应性较低;3)副反应较多(烷基取代的 1,3-二烯易发生烯丙基重排)。
近日,新加坡国立大学的许民瑜(Ming Joo Koh)教授(点击查看介绍)与中国科学院上海有机化学研究所的施世良研究员(点击查看介绍)等人利用手性NHC-Ni(0)催化剂触发选择性碳镍化/官能团化(carbonickelation/functionalization)的串联反应策略,开发了一种镍催化的烯烃对映选择性偶联的方法,成功地构建了一系列含有叔或季碳立体中心的化合物(图1c),为大多数取代烯烃和1,3-二烯的对映选择性碳官能团化提供了一种通用平台。机理研究表明:该方法是通过手性碳-镍配合物进行的,并通过碳镍化获得β-支链烷基镍物种。相关成果发表在Nature Catalysis 上。文章的共同第一作者是刘晨飞,王子超和罗晓华。

图1. 利用非贵金属开发烯烃对映选择性偶联反应的重要性。图片来源:Nat. Catal.
受前人工作的启发,作者希望利用手性NHC-Ni配合物来实现烯烃的对映选择性偶联反应。基于Ni(I)催化非对映选择性偶联反应的初步研究,作者假设手性芳基/烯基-镍物种V优先在烯烃的π键上发生区域和对映选择性碳镍化生成中间体VI(图2a),以减少配体和烯烃取代基之间的不利空间作用。随后,VI发生醇盐配体交换和氢转移获得中间体IX,经还原消除便可获得所需产物。从机理上讲,碳镍化/氢转移过程与先前方法(图1b)并不相同:其中决定立体选择性的C-C键要先于C-H键形成,并且空间效应控制了V→VI的区域选择性,而I→II则是通过电子效应控制。此外,立体化学在C-Ni键形成中已确定,因此可以用碳基试剂对VI中的C-Ni键进行官能团化来获得二碳官能团化加合物,而加氢金属化催化体系却无法实现(图1b)。
基于上述假设,作者选择苯乙烯(6)、碳亲电试剂和氢源对反应条件进行优化,结果显示6、芳基三氟甲磺酸酯(7)和异丙醇钠在Ni(cod)2(10 mol%)为催化剂、手性NHC(L1,10 mol%)为配体、NaOtBu(20 mol%)为碱、甲苯为溶剂的条件下于40 ℃反应16 h,能以95%的收率、>98:2 r.r.值和98:2 e.r.值得到所需产物8(图2b),并通过X-衍射分析证实了其绝对构型。此外,对照实验表明过量的NaOiPr会抑制副反应的发生(图2c),而降低NaOiPr的当量则会导致反应效率下降但并不影响位点/对映选择性,这表明足量的外源醇盐可促进中间体VI通过VIII和IX转化为加氢芳基化产物8,从而支持了决定立体选择性的C-C键先于C-H键形成的设想。值得一提的是,消旋的trans-乙烯基环丙烷10在标准条件下进行反应时生成了预期的加合物12,这表明此过程不是通过α-支链烷基镍II(图1b)或长寿命自由基物种进行的。另一方面,EPR分析显示反应混合物中并不存在顺磁性物质,进而说明该反应遵循Ni(0)/Ni(II)机制。
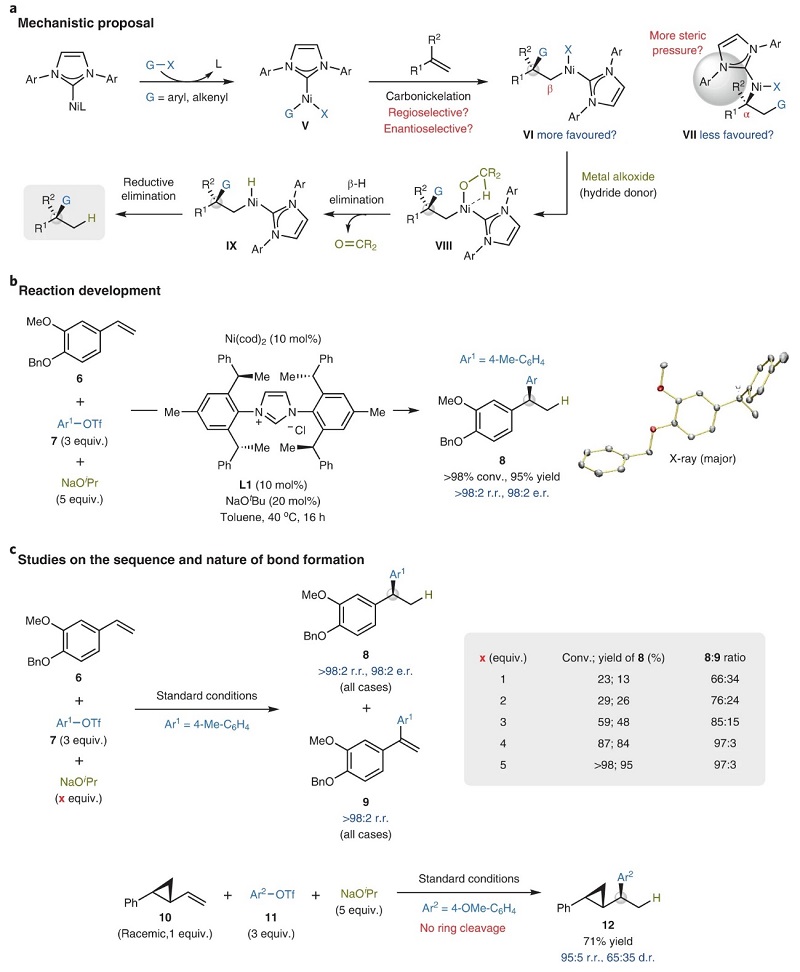
图2. 反应设计和机理研究。图片来源:Nat. Catal.
在最优条件下,作者对一系列官能团化的烯烃和1,3-二烯的底物兼容性进行了考察,结果显示不同基团(如:甲硅烷基醚(14、17)、Lewis碱性胺(15)、杂环取代基(18、23、24)、不同电性的芳烃(19-22)、烯基(26))取代的1,1-二取代烯烃均能实现这一转化(图3a),并以良好的收率、区域和对映选择性获得相应的季碳立体中心(13-26)。另外,该方法还能制备氘甲基(CH2D、CHD2、CD3)取代的季碳立体中心(27-29),进一步展示出该方法对构建药物骨架的重要性。其次,单取代烯烃和1,3-二烯也能兼容该反应(图3b),例如:不同电性基团(30-38)和杂芳基(40-42)取代的苯乙烯以及氮、氧、硅取代的烯烃(44-50)均能以良好的收率和对映选择性得到相应的叔碳立体中心,甚至还能合成生物活性分子N1L蛋白拮抗剂43。此外,芳基-1,3-二烯(51-63)和烷基-1,3-二烯(64-66)都能以良好的区域和对映选择性在末端双键上进行反应,进而有助于获得芳基烯丙基骨架(如:抗癌药物候选物4及其三氘代变体5)。
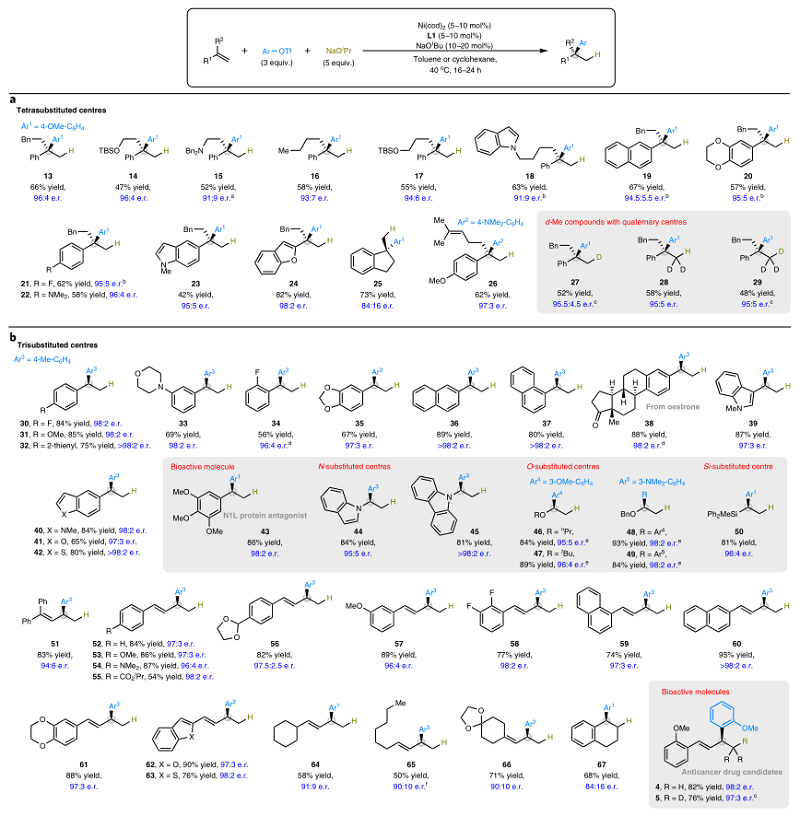
图3. 烯烃底物范围的探索。图片来源:Nat. Catal.
如图4a所示,作者还探索了碳亲电试剂的底物范围,结果显示邻位、间位和对位带有富电子/吸电子的芳基三氟甲磺酸酯均可进行位点和对映选择性加氢芳基化反应,并获得一系列具有季碳(68-71)或叔碳(72-82)立体中心的产物。类似地,不同基团(如:六至八元环烯烃(83-89、92-94)、无环烯烃(90-91))取代的烯基三氟甲磺酸酯也可兼容该反应(图4b),并以良好的收率和选择性得到相应产物。最后,作者试图利用有机金属亲核试剂取代NaOiPr以安装两个不同的碳基团(图4c),即亲核试剂与中间体VI发生金属转移获得烷基镍中间体X。事实上,多种sp2-和sp3-杂化的有机镁/锌化合物可作为有效的偶联试剂,并以优异的区域和对映选择性得到所需产物(95-106),特别是通过芳基化(95)、烯基化(96)和烷基化(97)构建了空间拥挤的四取代立体中心。值得注意的是,不同电性的芳基金属亲核试剂(98-102)均可实现对映选择性的1,2-二芳基化,甚至芳香族和脂肪族-1,3-二烯以及杂原子取代的烯烃也能以良好的对映选择性获得二芳基化产物(103-106)。此外,从不同的底物出发,使用相同的手性催化剂便可在标准条件下获得两种对映体(107和107’)。
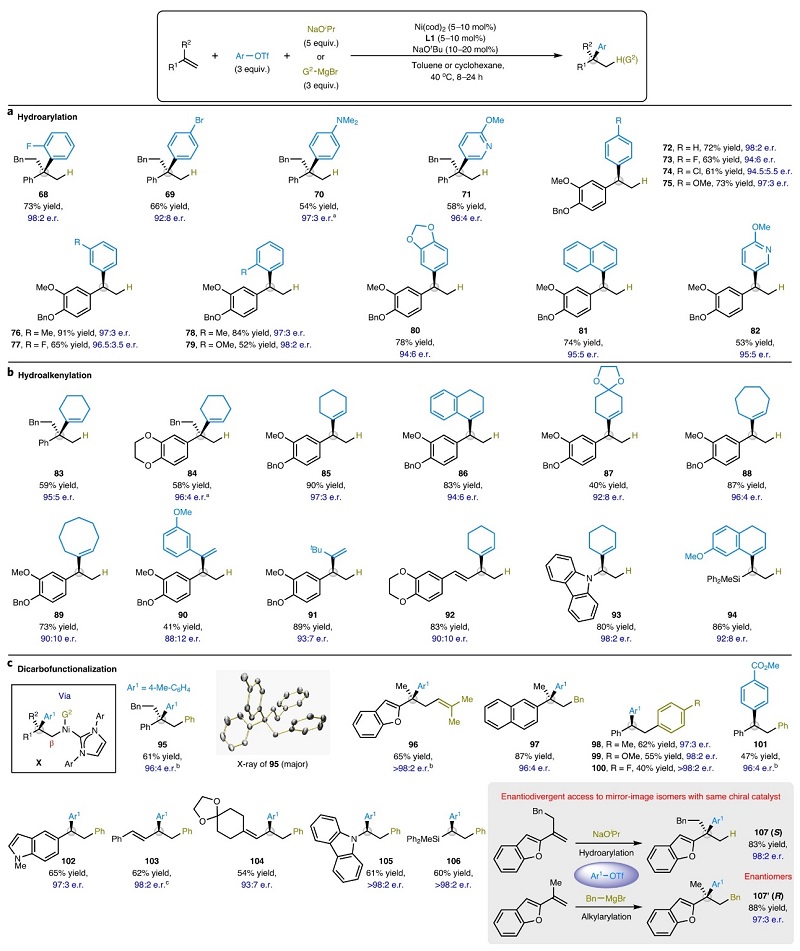
图4. 亲电和亲核试剂底物范围的探索。图片来源:Nat. Catal.
总结
本文作者利用手性NHC-Ni(0)催化剂触发选择性的碳镍化/官能团化的串联反应策略,开发了一种镍催化的烯烃对映选择性偶联的方法,成功地构建了一系列含有叔或季碳立体中心的化合物。该方法不仅为大多数取代烯烃和1,3-二烯的对映选择性碳官能团化提供了一个通用平台,而且极大地丰富了不对称催化的工具箱,促进了天然产物合成和药物发现进程。
许民瑜课题组常年诚邀博士后加入并接受博士生申请,有意者请联系chmkmj@nus.edu.sg。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Synthesis of tri- and tetrasubstituted stereocentres by nickel-catalysed enantioselective olefin cross-couplings
Chen-Fei Liu, Zi-Chao Wang, Xiaohua Luo, Jiawei Lu, Charyl Hui Min Ko, Shi-Liang Shi, & Ming Joo Koh
Nat. Catal., 2022, 5, 934-942. DOI: 10.1038/s41929-022-00854-8
导师介绍
许民瑜
https://www.x-mol.com/university/faculty/47854
施世良
https://www.x-mol.com/university/faculty/65879
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号