近红外光激活惰性铂配合物克服肿瘤耐药性
铂类抗癌药物是临床上治疗各种肿瘤的主要化疗药物,其作用机制被认为是通过损伤DNA诱导细胞凋亡。但是耐药性和毒副作用经常困扰铂类药物的临床治疗效果,因此需要开发新的药物解决这些问题。光动力疗法(PDT)用于癌症治疗已有40多年的历史,数以百计的光敏剂已应用于临床前或临床PDT。但是除了一些四吡咯衍生物外,大多数基于金属配合物的光敏剂只能被蓝光或可见光激发,由于激发光组织穿透力弱,无法治疗深层或大型肿瘤。为此,需要研发吸收波长在600‒900 nm范围内的光敏剂,通过双光子吸收(TPA)过程来实现PDT目标。普通的光敏剂TPA效率通常较低,容易对健康组织产生副作用,不能用于双光子光动力治疗(TP-PDT);可行的TP-PDT光敏剂必须具有较高的TPA效率。
基于铂配合物的光敏剂在癌症PDT中可以实现激活过程的时空控制,从而提高治疗的选择性。四价铂配合物作为光敏剂已有较多报道,但是其缺点是完全或部分借助释放二价铂物种与DNA作用来抑制肿瘤细胞,因此无法避免现有铂类药物的耐药性和系统毒性。而某些二价铂配合物常常在近红外(NIR)区展现出高TPA效率,是潜在的PDT光敏剂。其中重原子铂的存在可以促进自旋轨道耦合,导致超快、高效的三重激发态布居和高产率的ROS。然而,这些配合物一般具有一定的暗毒性,只能发生II型光动力反应,需要有氧微环境才能产生细胞毒性单线态氧(1O2)。由于实体瘤通常生长在缺氧环境中,这使氧依赖性光敏剂的有效性严重下降。要克服这个障碍,需要能与生物分子发生I型光动力反应的光敏剂,它们多为含叶绿素和金属中心大环的过渡金属配合物。
南京大学王晓勇教授研究团队最近设计合成了以萘酰亚胺衍生物为光敏配体的新型N^N^N环金属二价铂配合物PtPAN(图1)来解决上述问题,其中萘酰亚胺衍生物配体可以增强配合物在可见光区的吸收。PtPAN在常氧和乏氧条件下表现出良好的光稳定性;经过光照发生I型和II型光动力反应,形成1O2、•OH、H2O2和O2•‒等ROS(图2);对各种肿瘤细胞具有低暗毒性和强光毒性(表1)。
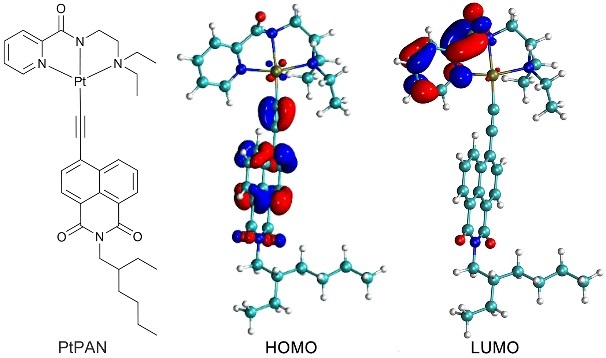
图1. 铂基光敏剂PtPAN的化学结构式及分子轨道
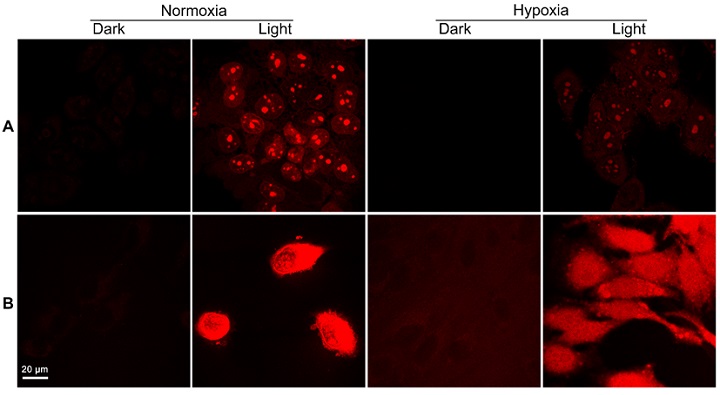
图2. 在常氧和乏氧条件下无光或光照经PtPAN(0.5 μM, 2 h, 37°C)处理的MCF-7细胞产生ROS。(A)O2•‒(DHE,10 μM,30 min),(B)•OH(HPF,10 μM,1 h)
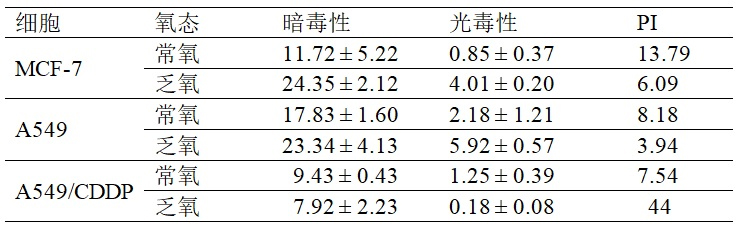
表1. PtPAN在常氧和乏氧状态下对不同肿瘤细胞的暗毒性和光毒性(IC50,μM,24 h;825 nm,60 mW/cm2,2 min)及光毒性指数(PI)
PtPAN在黑暗中不与DNA反应,表现出较低的细胞毒性,这意味着它可以克服铂类药物与DNA相关的副作用,如耐药性和系统毒性;但是在近红外光照射下PtPAN能产生ROS,所以能诱导肿瘤细胞死亡(图3),而且对顺铂耐药细胞A549/CDDP更加有效。体内试验证明,低剂量的PtPAN(2 mg/kg)在双光子近红外光照射下可以抑制荷瘤小鼠的肿瘤生长,其副作用可以忽略不计,说明系统毒性很低(图4)。
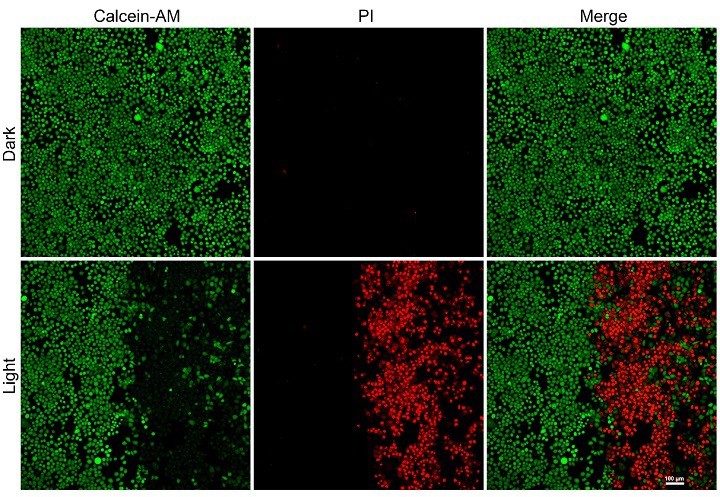
图3. MCF-7细胞与PtPAN(2 μM)孵育2 h后用钙黄绿素-AM/PI染色,在无光或近红外双光子激光照射(λ = 825 nm)10 min(60 mW/cm2)后的死亡(红色)或存活(绿色)状态
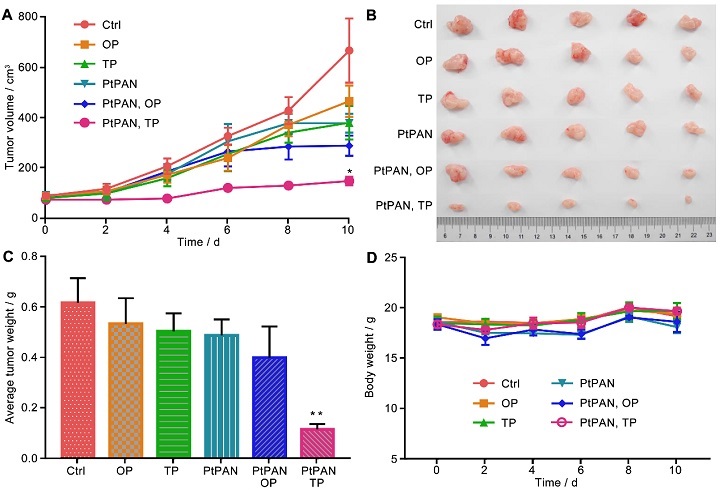
图4. PtPAN对荷MCF-7人乳腺癌异种移植瘤裸鼠在单光子(OP)或双光子(TP)光照射下的体内PDT效果。(A)肿瘤体积变化,(B)典型肿瘤图像,(C)平均肿瘤重量,(D)小鼠平均体重
总之,本研究设计的环金属二价铂光敏剂PtPAN可以同时进行I型和II型光动力反应,在体内通过生成ROS治疗癌症。与现有铂基光敏剂相比,PtPAN具有以下优点:(一)化学和光稳定性强,不直接与DNA反应,与传统铂类抗癌药物的作用机制完全不同;(二)通过破坏线粒体膜结构和光照氧化损伤DNA诱导细胞凋亡,对肿瘤细胞具有低暗毒性和高光毒性;(三)PDT效应不受肿瘤微环境氧气浓度限制;(四)可以用双光子近红外光(825 nm)照射激活,几乎可以根除体内肿瘤。铂基双光子光敏剂为解决PDT对乏氧实体瘤疗效低下和紫外-可见光激活穿透力浅问题提供了新机会。目前在肿瘤乏氧环境中可被双光子激活、能同时抑制肿瘤生长和克服铂类药物耐药性的铂基光敏剂还很少见。遗憾的是PtPAN的作用机制细节尚不清楚,而且对肿瘤细胞缺乏特异性,未来在这些方面还需要进一步探索。
论文发表在J. Med. Chem.上,第一作者是南京大学生命科学院博士生王延俊,通讯作者是南京大学医药生物技术国家重点实验室王晓勇教授。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Platinum-Based Two-Photon Photosensitizer Responsive to NIR Light in Tumor Hypoxia Microenvironment
Yanjun Wang, Xiangchao Shi, Hongbao Fang, Zhong Han, Hao Yuan, Zhenzhu Zhu, Lei Dong, Zijian Guo, and Xiaoyong Wang*
J. Med. Chem., 2022, 65, 7786–7798, DOI: 10.1021/acs.jmedchem.2c00141
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!










































 京公网安备 11010802027423号
京公网安备 11010802027423号