贝莱斯芽孢杆菌FZB42的隐性NRPS基因簇挖掘显示单个游离氧化酶迭代催化多联噻唑的形成
非核糖体多肽(NRPs)是药物的重要来源之一,噻唑环作为NRPs中常见且重要的药效官能团,其研究一直备受关注,如抗肿瘤药物博来霉素中的二联噻唑环被证实能辅助化合物嵌入DNA。此外,肽类化合物活性的强弱与相联的噻唑环数量呈正比例关系。发现新型多联噻唑类化合物并解析其生物合成机制具有重要意义。噻唑环的生物合成过程为半胱氨酸的侧链硫醇攻击新生肽键,之后脱水产生噻唑啉;随后噻唑啉的α-β键进一步双电子氧化生成噻唑环。微生物进化出两种不同的酶系统来构建噻唑环,一种是通过NRPS,另一种发现于核糖体合成和翻译后修饰多肽(RiPPs)中。在NRPs体系中,多联噻唑啉的氧化通常由整合型氧化(Ox)结构域根据“共线性”原则催化,即氧化步骤与Ox结构域组成呈对应关系。而RiPPs体系则迭代使用含脱氢酶的复合体,完成多个杂环的氧化。目前尚未有游离氧化酶迭代催化NRPs中多联噻唑啉氧化的报道。

图1. 微生物天然产物中合成多联噻唑的主要策略。(A)NRPs中使用顺式作用的Ox结构域;(B)RiPPs体系中的迭代策略;(C)该研究中发现的在NRPs中使用反式氧化酶,NRPS模块没有整合型的Ox结构域。
近日,国际知名期刊ACS Catalysis 在线发表了山东大学微生物技术国家重点实验室张友明院士(点击查看介绍)团队卞小莹教授(点击查看介绍)课题组在非核糖体多肽(NRPs)生物合成领域的重要成果。该项研究不仅以基因组信息为指导定向挖掘了Bacillus velezensis FZB42中一个隐性NRPS基因簇,获得了一系列新颖的多联噻唑类化合物bacillothiazols A-N,解析了其生物合成途径,还通过体内/外生化实验首次阐释了NRPs中多联噻唑非线性氧化的作用机制,展现了NRPS的可塑性和多样性。
通过基因组挖掘、直接克隆和异源表达、体内敲除实验、酶生化功能表征、结构预测结合定点突变等多学科交叉方法,该研究取得如下主要结果:
(1)解码了模式植物根际促生菌B. velezensis FZB42中的一个隐性NRPS基因簇(nrs)合成的产物,该基因簇的产物是自2007年FZB42公布基因组以来的未解之谜,FZB42发明人、著名微生物学家、柏林洪堡大学教授Rainer Borriss教授认为该研究解决了他们团队近20年未解的nrs基因簇谜题(在给作者信中写道“YOU HAVE SOLVED THIS PUZZLE; WHICH WE HAVE TRIED TO DO FOR NEARLY TWO DECADES”)。本研究发现其为一系列罕见的三联噻唑类化合物bacillothiazols A-N,对治疗Ⅱ型糖尿病和肥胖症的极具吸引力的靶点—蛋白酪氨酸磷酸酶PTP1B具有很强的选择性抑制活性;

图2.(A)基因组挖掘B. velezensis FZB42中的一个隐性NRPS基因簇nrs,NRPS模块没有整合型的Ox结构域;(B)nrs基因簇合成的多联噻唑类化合物bacillothiazols A-N(1-14)的结构。
(2)研究了bacillothiazols的生物合成过程,发现与经典的NRPs中噻唑环的形成过程不同,游离的氧化酶NrsB在bacillothiazols组装过程中被迭代使用,将多个噻唑啉氧化为噻唑环;
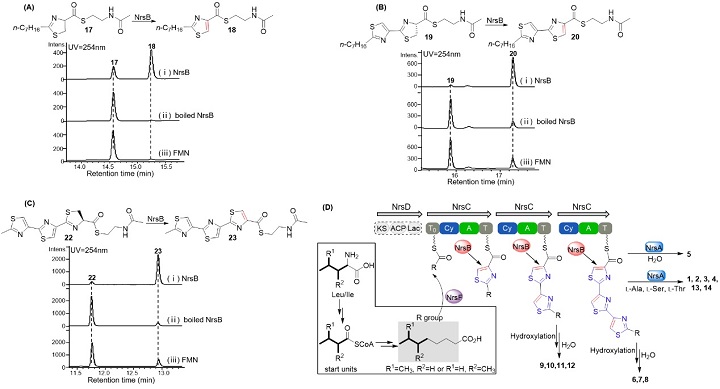
图3.(A),(B),(C)分别为NrsB的体外反应结果;(D)bacillothiazols的生物合成途径推测。
(3)相比于Ox结构域,NrsB的活性位点与RiPPs脱氢酶的更为相似,都为赖氨酸-酪氨酸基序,据此提出了NRPs中多联噻唑迭代氧化的机制,该机制与RiPPs中推测的相似,都是基于E2消除反应的机理,但是作用方式不同。
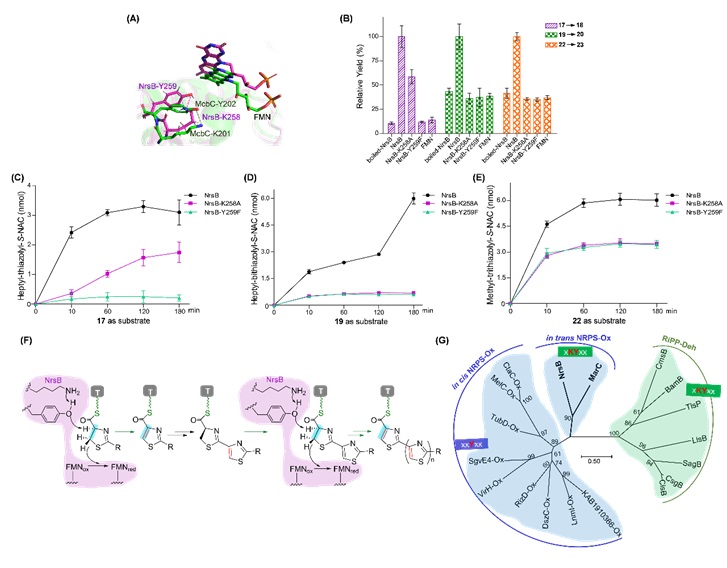
图4. NrsB的催化机理探究。(A)通过将模拟的NrsB结构(洋红色)与脱氢酶McbC的晶体结构(绿色)比对,推测NrsB的活性位点为Lys258和Tyr259;(B)野生型NrsB和突变型NrsB介导氧化的比较,化合物17,19和22分别为模拟的底物heptyl-thiazolinyl-S-NAC,L-heptyl-thiazole-thiazolinyl-S-NAC和L-methyl-bithiazole-thiazolinyl-S-NAC,化合物18,20和23分别为噻唑啉氧化后得到的产物Heptyl-thiazolyl-S-NAC,Heptyl-bithiazolyl-S-NAC和Methyl-trithiazolyl-S-NAC;(C),(D),(E)分别为产物随时间的生成量;(F)NrsB的催化机制推测;(G)NrsB的进化树分析。
噻唑啉氧化噻唑环这一过程对化合物的结构稳定性和活性有着诸多益处。该研究不仅解决了FZB42中最后一个隐性NRPS基因簇所对应天然产物的未解之谜,还首次发现了自然界中合成噻唑环的新方式,推导了非核糖体肽生物合成途径中多联噻唑环的迭代氧化机制,为基因组定向挖掘和组合生物合成改造噻唑类化合物提供了良好的研究基础。
该项研究工作得到了国家重点研发计划、国家自然科学基金、山东省自然科学杰出青年基金、山东大学青年交叉科学创新群体等项目的资助。山东大学为第一完成单位和通讯作者单位,卞小莹教授为论文通讯作者,研究团队的博士毕业生申琪瑶和助理研究员周海波为共同第一作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Characterization of a Cryptic NRPS Gene Cluster in Bacillus velezensis FZB42 Reveals a Discrete Oxidase Involved in Multithiazole Biosynthesis
Qiyao Shen, Haibo Zhou, Guangzhi Dai, Guannan Zhong, Liujie Huo, Aiying Li, Yang Liu, Ming Yang, Vinothkannan Ravichandran, Zhihui Zheng, Ya-Jie Tang, Nianzhi Jiao, Youming Zhang, and Xiaoying Bian*
ACS Catal., 2022, 12, 3371–3381, DOI: 10.1021/acscatal.1c05131
导师介绍
张友明
https://www.x-mol.com/university/faculty/60223
卞小莹
https://www.x-mol.com/university/faculty/60224
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!













































 京公网安备 11010802027423号
京公网安备 11010802027423号