基于TMB光热效应驱动的Bar−Chart微流控可视化免疫分析芯片
酶联免疫吸附测定(ELISA)是一种常规的免疫分析方法,被广泛用于各类疾病标志物的免疫检测,研究具有现场即时检测(POCT)潜力的新型ELISA方法也成为研究的热点。近日,宁波大学的付光磊副教授(点击查看介绍)课题组与德克萨斯大学埃尔帕索分校(UTEP)的李秀军教授(点击查看介绍)合作报道了一种基于3,3',5,5'−四甲基联苯胺(TMB)光热效应驱动的Bar−Chart微流控可视化免疫分析芯片。
TMB是常规ELISA及生化分析中应用较为广泛的显色底物之一,在各类商品化试剂盒中被大量使用。在H2O2的存在下,辣根过氧化物酶可催化TMB的氧化(即显色反应),通过读取反应产物(OXTMB)在650 nm处的吸光度,进行免疫检测。然而,上述过程往往需要借助大型、昂贵的分析仪器(如酶标仪),在一定程度上限制了其在POCT中的应用潜力。该团队的前期研究首次发现(Anal. Chem., 2018, 90, 5930−5937)TMB的单电子氧化产物—OXTMB具有显著的近红外光热效应,可作为一种新型近红外光热探针,实现免疫检测信号的光热转换,从而采用简单、便携的数字温度计定量读取免疫检测信号,基于相似原理的光热免疫分析方法也相继有较多报道。尽管如此,这些方法大多在常规96孔板、PCR管或比色皿中进行,集成性及微型化不足,光热检测过程也相对较为繁琐。
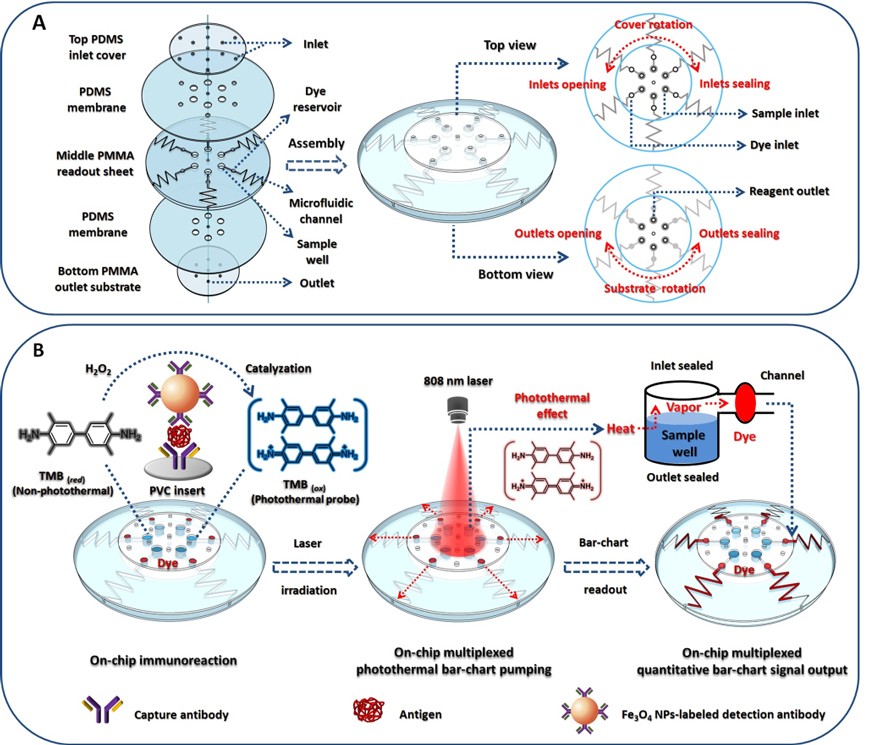
图1. 光热Bar−Chart微流控免疫分析芯片示意图:(A)芯片结构;(B)工作原理。
针对上述问题,在前期研究基础上(Lab Chip, 2020, 20, 2218−2227),该团队进一步将基于TMB显色的ELISA体系和光热微流控驱动技术集成到单个微流控芯片中,研究了一种新型光热Bar−Chart微流控可视化免疫分析芯片。如图1所示,该芯片采用一种可旋转开关设计来控制芯片内的微流控环境,以OXTMB作为芯片上的光热免疫检测探针,其光热效应可驱动染料在微流控通道内定量移动,从而实现免疫检测信号以Bar−Chart的形式可视化定量显示。该团队首先设计了一种气压测试芯片,通过实时监测激光照射过程中密闭芯片环境内的气压(差压)变化,验证了芯片的工作原理。如图2所示,OXTMB的光热效应可导致样品池内产生显著的气压升高,从而推动预装载的染料在微流控通道内定量移动,形成可视化Bar−Chart信号。以前列腺特异性抗原(PSA)为检测模型,采用人工过氧化物模拟酶—Fe3O4纳米粒子标记检测抗体,以染料的Bar−Chart移动距离为可视化免疫检测信号,该芯片对PSA的检测限(LOD)可低至1.9 ng/mL,低于前列腺癌的临床诊断阈值(4.0 ng/mL)。单个芯片可实现6个样品的同时检测。此外,该芯片还表现出了较理想的选择性以及用于血清样本中PSA检测的准确性。
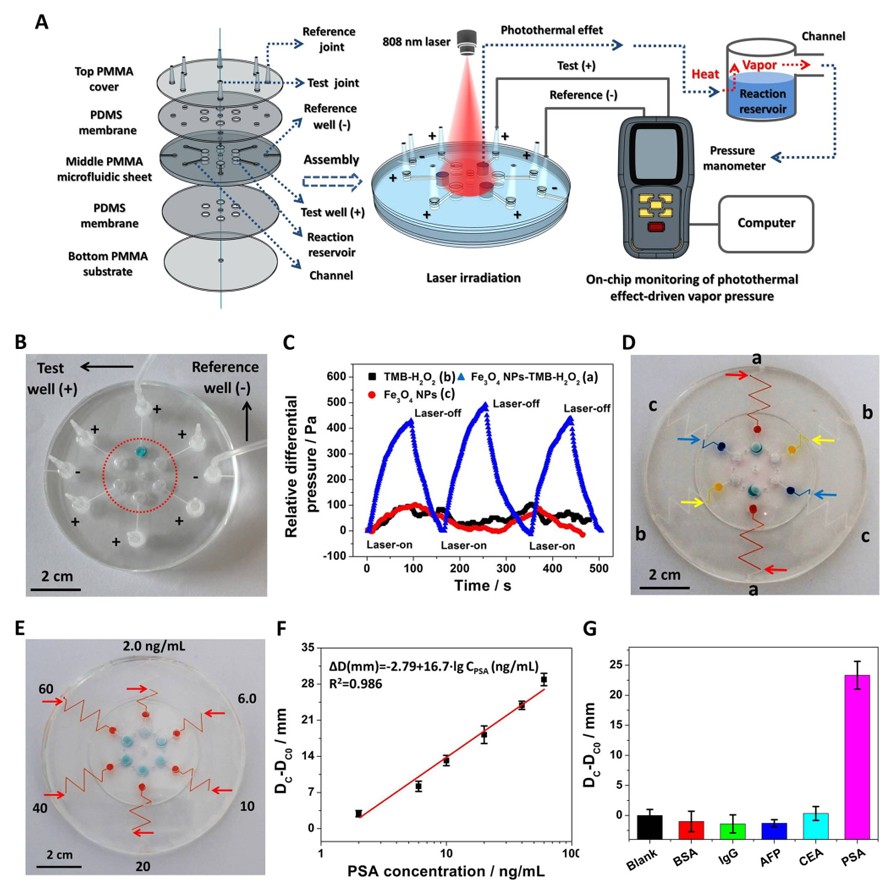
图2. 芯片的工作机理验证:(A−B)气压测试芯片示意图与照片;(C)样品池内差压监测结果;(D)Bar−Chart信号;PSA的可视化免疫分析:(E−F)免疫分析结果;(G)选择性。
该工作为基于TMB显色的ELISA及各类生化分析信号的定量可视化提供了一种新思路。和一些已报道光热免疫分析方法相比,该芯片具有一定的集成性和便携性,操作过程也有所简化,还可实现多样品的同时检测。这一研究成果近期发表在Analytical Chemistry 上,文章的第一兼通讯作者为付光磊副教授,李秀军教授为共同通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Integration and Quantitative Visualization of 3,3′,5,5′-Tetramethylbenzidine-Probed Enzyme-Linked Immunosorbent Assay-like Signals in a Photothermal Bar-Chart Microfluidic Chip for Multiplexed Immunosensing
Guanglei Fu*, Ruixia Hou, Xianbo Mou, Xiujun Li*
Anal. Chem., 2021, 93, 15105−15114, DOI: 10.1021/acs.analchem.1c03387
付光磊博士简介

付光磊,宁波大学医学院副教授。2013年于哈尔滨工业大学取得博士学位,生物医学工程专业,2013年10月至2016年5月先后在新加坡南洋理工大学和美国德克萨斯大学艾尔帕索分校从事博士后研究,2016年11月起就职于宁波大学。
研究领域是生物医学传感、微流控生物分析芯片、纳米诊疗剂。以第一或通讯作者在Anal. Chem.、Lab Chip、Biosens. Bioelectron.、ACS Sens.等期刊发表论文15篇。代表性工作:(1)发现临床药物—普鲁士蓝纳米粒子(PB NPs)的近红外光热效应,并将其应用于癌症的光热治疗(Chem. Commun., 2012, 48, 11567−11569;被引次数:233);(2)将光热效应引入到传统免疫分析体系及微流控芯片中,提出光热免疫分析新方法和光热微流控驱动技术(Lab Chip, 2020, 20, 2218−2227;Nanoscale, 2016, 8, 5422−5427;被引次数:104);(3)发现3,3',5,5'−四甲基联苯胺(TMB)单电子氧化产物的近红外光热效应,并将其应用于光热免疫分析(Anal. Chem., 2018, 90, 9, 5930−5937;被引次数:101)。
https://www.x-mol.com/university/faculty/160154
李秀军博士简介

李秀军,美国德克萨斯大学埃尔帕索分校(The University of Texas at El Paso,缩写UTEP)终身副教授,2008年于加拿大西门菲莎大学(Simon Fraser University,SFU)取得博士学位,2008至2009年在美国加州大学伯克利分校(UC Berkeley)从事博士后研究,2010年至2011年在哈佛大学(Harvard University)师从著名的George Whitesides教授从事博士后研究,2012年初就职于UTEP。
李秀军课题组的研究领域是面向微流控生物芯片和纳米技术在生物分析、生物医学和环境方面的应用,特别是专注于低成本诊断、病原体和癌症标志物的快速检测、纳米生物传感器、组织工程和单细胞分析等领域的创新和研发。李秀军课题组首次实现了用常规温度计来进行定量生物分析。其在相关领域发表SCI论文106篇,包括以通讯作者身份发表Chem. Sci.、Adv. Drug Deliv. Rev.、TRAC-Trend Anal. Chem.、Appl. Catal. B-Environ.、Nanaoscale、Anal. Chem.、Chem. Commun.、Biosens. Bioelectron.、Lab Chip等,发明专利22项,并在Elsevier出版3本专著(例如Microfluidic Devices for Biomedical Applications);担任Nature Publishing Group旗下Scientific Reports和Micromachines等多家期刊的资深编辑,Lab Chip 和 Analyst 的Advisory Board成员;曾获得“Bioanalysis Young Investigator Award” (2014)、Outstanding Faculty Research Mentoring Award(2018和2016两次)、NIH BUILDING Scholar Mentoring Award (2017) 、UT STARS Award (2012)、Dean of Graduate Studies Convocation Medal from SFU (2009)以及中国国家优秀自费留学生奖(2004)等。
https://www.x-mol.com/university/faculty/46687
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号