发过ACS Catal的酶,还能再挖掘出一篇Nat Chem
副标题:双功能酶催化,对映选择性构建碳氮键
含氮化合物是一类重要的有机化合物,不仅具有重要的生物活性,而且广泛应用于医药、农药化学品以及功能材料等领域中,因此开发有效的C-N键构建方法一直是现代有机化学和生物化学的重要研究方向之一。在小分子催化中,不对称N-H键插入的常见策略是利用过渡金属催化剂进行卡宾转移,接着使用单独的手性质子转移催化剂进行立体诱导(图1a)。也就是说,该过程需要严格避免其它质子源,以确保高效地进行不对称转化。在过去的几年里,金属血红素依赖性酶(如:细胞色素P450、细胞色素c和珠蛋白)通过定向进化能够高效、高选择性地催化非天然卡宾和氮宾转移反应,并成功地实现了环丙烷的合成、高张力双环丁烷的构建以及碳‒硅键和碳‒硼键等非天然化学键的构筑。尽管血红素蛋白可促进卡宾N-H键插入反应且催化效率远远超过小分子催化,但是要想高立体选择性地实现N-H键插入反应仍是一个挑战。
美国加州理工学院的Frances H. Arnold教授(点击查看介绍)等研究者设想能否利用酶作为双功能催化剂,来执行诱导卡宾转移并促进随后的质子转移这两种不同的功能。如果可行,高对映选择性的生物催化N-H键插入反应将成为可能。近日,他们报道了工程化细胞色素P450酶催化的卡宾N-H键插入反应(图1b),以高产率和高对映选择性制备了一系列生物相关的α-氨基内酯,总周转数(TTN)高达32100。西班牙赫罗纳大学的Marc Garcia-Borràs博士和美国加州理工学院的陈凯博士(现加州大学伯克利分校Jennifer Doudna教授课题组博士后)为共同通讯作者,Arnold教授课题组博士后刘臻为第一作者。相关成果发表在Nature Chemistry 上。![]()
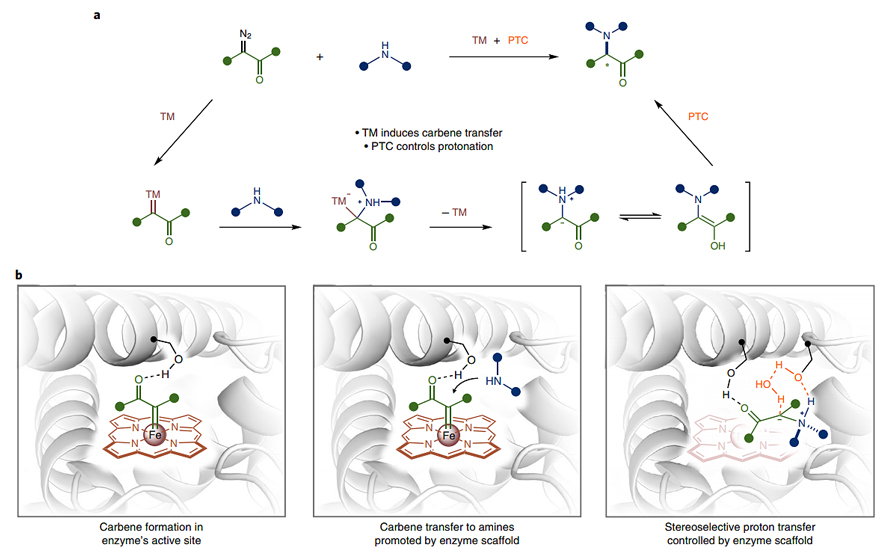
图1. 使用小分子催化剂和酶的不对称卡宾N-H插入。图片来源:Nat. Chem.
首先,作者选择内酯重氮化物1和N-甲基苯胺2a为模型底物,筛选了40种此前发展的用于卡宾及氮宾转化的不同血红素蛋白突变体(图2a)。虽然大多数突变体只表现出低活性(转化率<5%),但FAD结构域截短的P411变体L7(此前用于催化内酯-卡宾C-H键插入,ACS Catal., 2020, 10, 5393),却能有效地催化该N-H键插入反应(产率:81%,e.e.值:94%)。对该酶谱系进一步的评估表明L6和L7的效果最好(图2b)。若将L7恢复为全长P411(L7_FL),则能以92%的产率和95%的e.e.值得到目标产物3a,这可能要归功于全长蛋白的稳定性增加。他们发现,从L5到L6的单位点突变A264S对N-H键插入反应产生了巨大影响,特别是在对映选择性方面(-21%→92% e.e.),这表明位于血红素辅因子上方的264位氨基酸残基在促进内酯-卡宾转移过程和对映选择性决定步骤方面发挥着重要作用。随后,作者基于L6的全长蛋白(L6_FL)制备了五种在264位点处具有不同突变的突变体,并评估了它们在N-H键插入反应中的催化性能(图2c)。有趣的是,当原始的丝氨酸(S)突变为较小的氨基酸——丙氨酸(A)或甘氨酸(G),活性虽然差不多但选择性却大幅下降,这表明丝氨酸的亲水侧链可能参与对映选择性的控制。但是,具有亲水侧链但较大的氨基酸残基——天冬氨酸(D)、苏氨酸(T)和半胱氨酸(C),却带来了产率和立体选择性的双重下降。
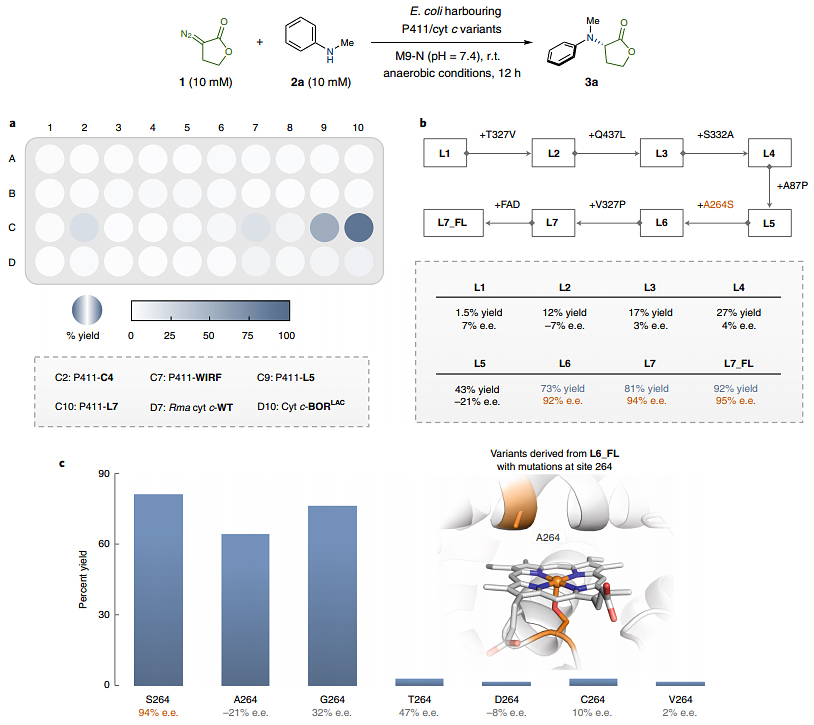
图2. 酶促N-H键插入反应的筛选及关键位点的确定。图片来源:Nat. Chem.
内酯卡宾结合突变体L6的分子动力学(MD)模拟表明,内酯在L6活性位点上主要表现为单一取向,264位丝氨酸残基(S264)侧链通过与内酯的酯基发生氢键相互作用从而稳定了这一取向(图3a)。在这种取向中,亲电卡宾只有一个面可以被亲核胺底物进攻,从而对映选择性地产生叶立德中间体。此外,作者发现涉及卡宾的羰基氢键相互作用可增强其亲电性,因此S264还有助于提高卡宾物种的反应活性。接着,作者模拟了胺底物2a对卡宾的作用以及随后在L6的活性位点中叶立德中间体的形成。如图3b所示,通过底物芳环和活性位点疏水氨基酸残基(L75、V328、L437、P329)之间的疏水相互作用稳定了胺底物与内酯卡宾的N-亲核加成,同时内酯基团和S264之间的氢键在叶立德形成时保持不变。此外,活性位点口袋中仅存在少数几个水分子(图3c,分子动力学模拟下的水分子位移轨迹),一个水分子从内酯环的顶面(pro-S面)将叶立德质子化,而第二个水分子使氨基去质子化(图3d)。总之,叶立德的对映选择性形成和水分子在质子转移活性位点的精确定位促使酶能够控制这种N-H键插入反应的选择性。
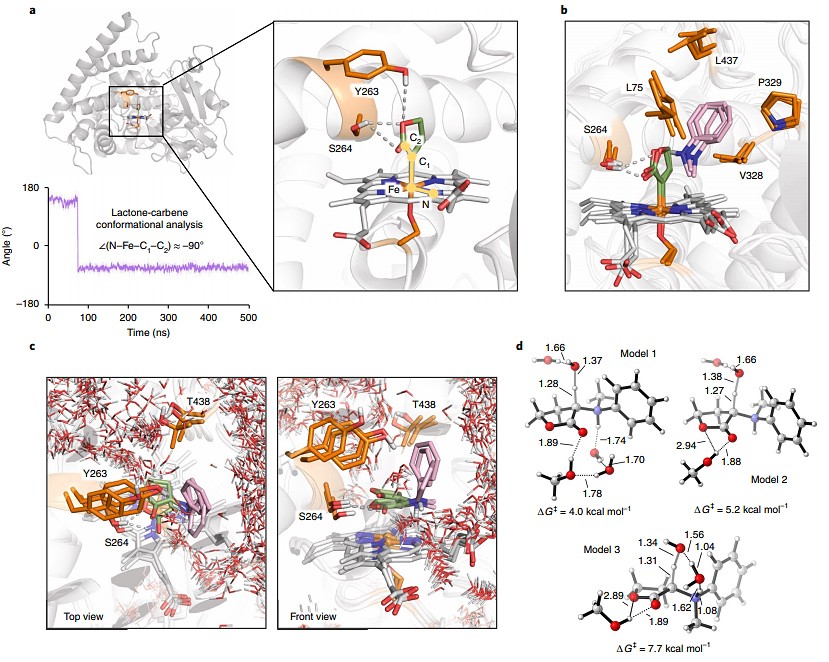
图3. 计算模型阐明对映选择性的起源。图片来源:Nat. Chem.
在标准的全细胞反应条件下,作者对胺亲核试剂的底物范围进行了考察(图4),结果显示带有N-烷基的二级苯胺(3b-3g)和不同基团取代的一级苯胺(3h-3m)均能兼容该反应,以良好的产率和优异的对映选择性得到所需产物,特别是两个邻位甲基取代的底物(3m)也能顺利地实现这一转化。由于脂肪胺的Lewis碱性比苯胺强,因此脂肪胺的不对称N-H键插入反应更具挑战性。令人高兴的是,L7_FL能够有效地催化伯胺(3n-3p)或仲胺(3q)进行不对称胺化,从而以良好的产率和对映选择性得到相应的α-氨基内酯产物。
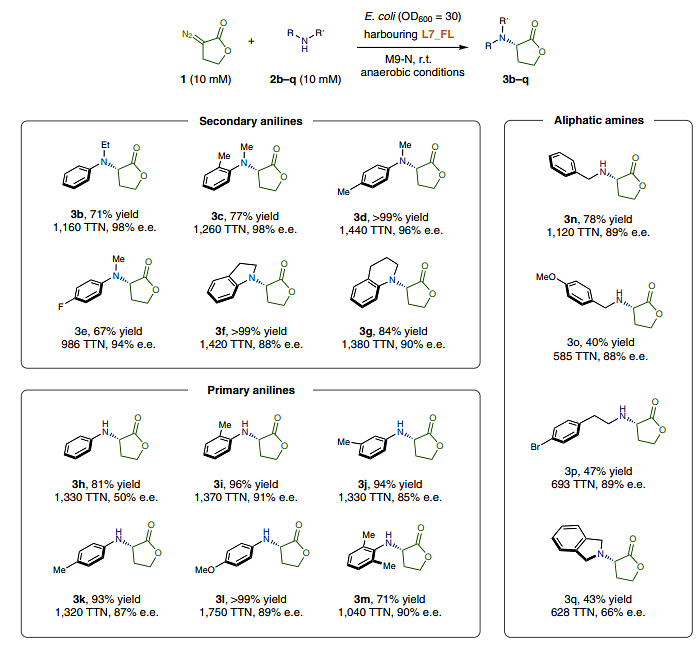
图4. 底物范围研究。图片来源:Nat. Chem.
为了证明这种生物催化策略的实用性,作者使用更低的酶负载量突破了酶的催化能力的极限。在标准条件下使用OD600=30的全细胞催化剂,反应的TTNs通常在1000-2000之间(图4)。令人欣慰的是,降低全细胞催化剂的量并没有导致产物形成的显著下降,TTN分别为9640 (OD600=5) 和32100 (OD600=1),这表明酶体系对于这种不对称胺化反应表现的特别稳健(图5a)。此外,酶促反应还能以克级规模进行制备,以97% 的分离产率和96%的e.e.值制备产物3d(图5b)。类似地,产物3e和3l还能以1 mmol规模制备,其晶体结构由单晶衍射确定。最后,作者还将这种酶促胺化策略应用于杀菌剂 ofurace的(S)-对映异构体的合成,其关键中间体3m通过酶促N-H键插入反应制备而成,分离产率为72%,e.e.值为91%。
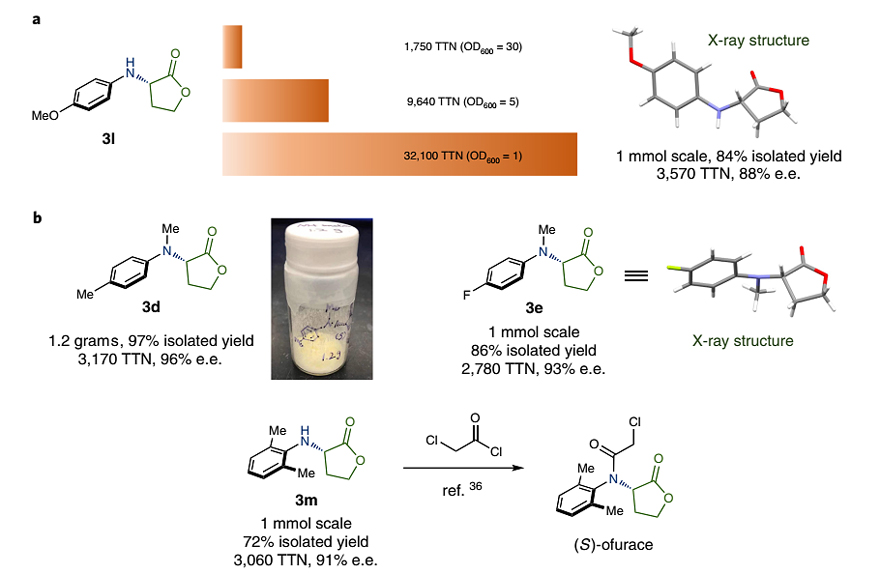
图5. L7_FL的催化效率研究和克级规模反应。图片来源:Nat. Chem.
总结
Frances Arnold教授等人开发了一种高对映选择性卡宾N-H键插入反应的酶催化策略,以高达>99%的产率和98%的e.e.值合成了一系列生物相关的α-氨基内酯产物。该反应的关键在于工程化的细胞色素P450酶充当双功能生物催化剂,不仅能促进内酯-卡宾向胺的转移,而且在随后的质子化步骤中发挥着出色的立体控制。可以预见,这种高效的酶催化体系可用于合成化学和药物研发中的生物活性手性胺的制备。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Dual-function enzyme catalysis for enantioselective carbon–nitrogen bond formation
Zhen Liu , Carla Calvó-Tusell, Andrew Z. Zhou, Kai Chen, Marc Garcia-Borràs , Frances H. Arnold
Nat. Chem., 2021, DOI: 10.1038/s41557-021-00794-z
导师介绍
Frances H. Arnold
https://www.x-mol.com/university/faculty/438
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号