用光给脑部疾病递药:激光活化分子靶向纳米颗粒可逆性打开血-脑屏障来实现药物传送
血脑屏障(blood-brain barrier, BBB)是维持中枢神经系统稳态和保护脑部组织免受代谢产物损伤的天然屏障,通过只让氧气等必须物质入脑且防止血液有害物质侵入来维持稳定的微环境,从而保证正常脑活动。它是由连续毛细血管的单层内皮以及内皮细胞间的紧密链接(tight junctions)、基膜(basement membrane)、周细胞(pericyte)和星形胶质细胞的足突(astrocyte endfoot)组成。它具有低转胞吞作用(transcytosis)特性,并实时与小胶质细胞的足突、神经元相互作用,形成神经-血管基本单元。然而,在保护神经系统的同时,血脑屏障也限制了98%的小分子药物和几乎所有的大分子药物无法有效到达脑组织。因此,开发安全可逆地打开血脑屏障并实现药物传输到脑的技术是一项具有临床意义的工作。
目前用于增加血脑屏障通透性的方法包括颈动脉注射高浓度甘露醇(mannitol),血管活性试剂激活胞吞作用,以及通过利用细胞穿透肽、可穿透血脑屏障的腺病毒相关病毒(AAV)以及受体介导的转胞吞作用来增加脑转运。这些方法会造成脑半球甚至全脑血脑屏障通透性增加,适合需要全脑治疗的疾病比如老年痴呆症,但不适合只需要局部治疗的疾病比如早期脑肿瘤。近几年,通过超声刺激微泡(microbubble)来实现局部增加脑渗透已经在进行早期临床试验,具有很大的应用前景。然而超声方法对于应用在复杂骨结构下面的组织具有局限性,比如脊柱下面的血脊屏障(blood-spinal cord barrier)。
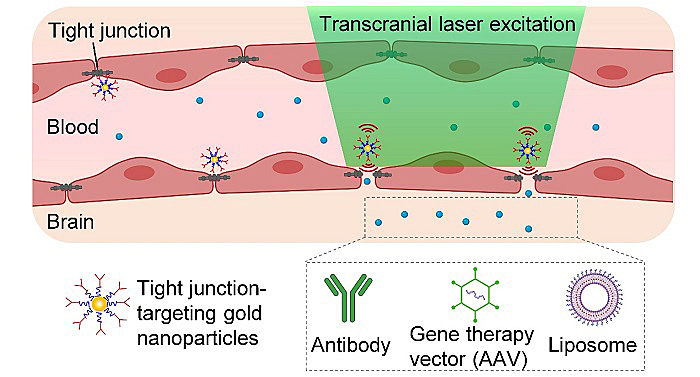
图1. 激光刺激分子靶向的纳米颗粒来实现可逆性打开BBB并传送药物到脑组织里面。
为了解决这些问题,德克萨斯大学达拉斯校区的秦真鹏教授团队和德克萨斯大学西南医学中心Robert Bachoo教授团队共同研发了一种通过皮秒脉冲激光照射分子靶向的纳米颗粒来实现安全可逆地打开血脑屏障并传送药物到脑组织里面的技术(图1)。此技术原理利用皮秒激光刺激靶向金纳米后在其周围纳米范围内产生的光震波效应,反映出来的形式为机械波,这种很小的机械波作用在紧密链接上面从而打开了血脑屏障。该团队首先合成了金纳米颗粒(AuNP),并通过抗体修饰,使其可以靶向紧密链接复合体的其中一种连接黏附分子A蛋白(JAM-A)。把修饰后的颗粒经尾静脉注射进小鼠后,用皮秒激光在头颅上方照射一个脉冲,就可以打开血脑屏障,并在低能量下血脑屏障在24小时内恢复正常(图2)。
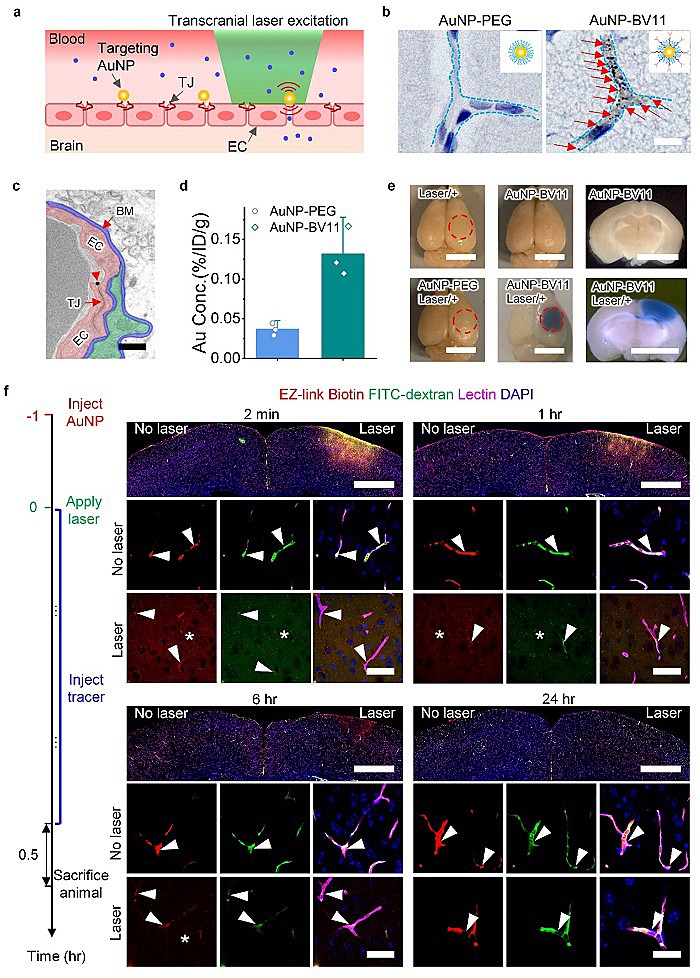
图2. 皮秒激光刺激靶向紧密链接的纳米颗粒来实现可逆性增加BBB渗透。(a)技术示意图。(b)分子靶向的金纳米颗粒(AuNP-BV11)通过银染来显示沿着脑血管的分布。(c)金纳米颗粒与紧密链接的共定位。(d)靶向的金纳米颗粒在小鼠大脑里面聚集的浓度比聚乙二醇修饰的金纳米颗粒(无靶向作用,AuNP-PEG)浓度高4倍。(e)用Evans blue染料来显示BBB渗透性增加。(f)打开的BBB对不同分子量的染料的渗透性恢复时间不一样,70kDa的大分子激光刺激6小时后就没有脑渗透了,660Da的小分子在24小时后不再进入脑组织。
为了研究该方法增加血脑屏障通透性的路径,即通过打开内皮细胞的紧密连接还是增加内皮细胞的胞吞作用,该团队在激光照射后经小鼠尾静脉注射重金属硝酸镧来示踪,并利用透射电子显微镜观察大脑切片发现,该技术可以打开部分紧密链接从而实现脑渗透增加(图3)。
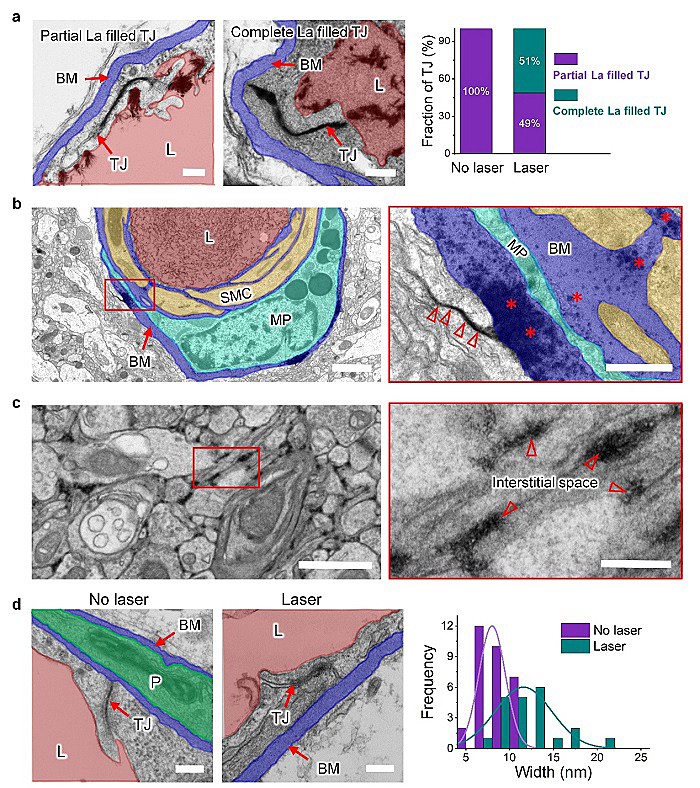
图3. 利用透射电子显微镜和硝酸镧研究BBB打开的路径。(a)镧示踪的紧密连接(Tight junction, TJ)。(b)镧扩散到基膜并渗入脑间隙。(c)镧在脑间隙的扩散。(d)激光照射后部分紧密链接的间隙宽度增加。
由于脑结构非常脆弱,所以任何一种在脑部应用的技术对安全性要求非常高。通过血管舒张和收缩,脑血管严格的调控血流以满足代谢需求和供给。阻断脑血管舒缩(vasomotion)可能会影响氧气和营养对脑局部的供给。该团队为了研究该技术的安全性,打开血脑屏障后,在清醒并且头部固定的小鼠上用双光子成像系统记录了小动脉和小静脉的血管舒缩变化,并证明在低能量下打开血脑屏障并没有影响脑血管舒缩(图4)。
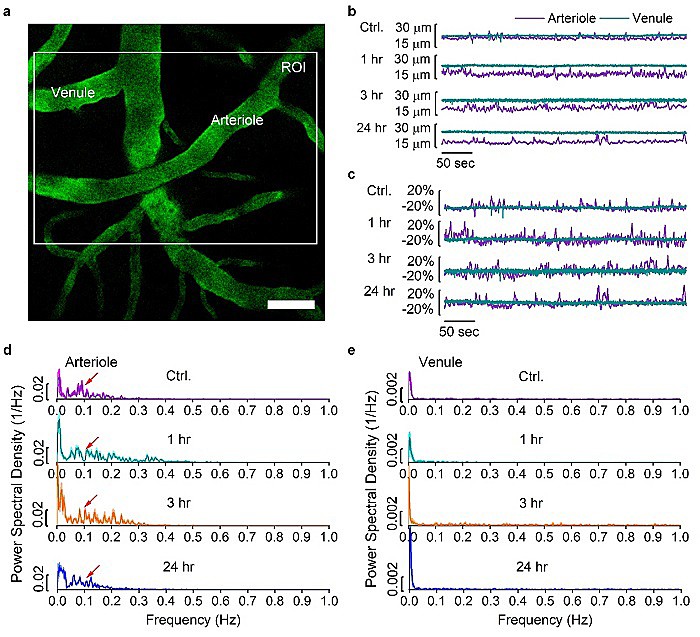
图4. 打开BBB没有影响自发性的血管舒缩(vasomotion)。(a)双光子活体成像的代表性图。(b)血管直径的变化。(c)血管直径变化的百分比。(d)小动脉的舒缩频率保持在0.1Hz。(e)小静脉和预计的一样没有舒缩。
该团队对血管的结构完整性和脑细胞代表性蛋白进行检测进一步研究这个技术的安全性。其结果表明通过用生物素(lectin)标记血管内的糖蛋白和免疫组化方法标记血管上面的葡萄糖转运体(Glut1),激光处理后的脑血管密度没有显著性差异(图5a-b)。免疫组化检测以下蛋白表达:神经元核抗原(NeuN)和轴突初始段蛋白(Ankyrin-G)、壁细胞星形胶质细胞足突上的水转运体(AQP4)和周细胞的神经胶质抗原2(neural glial antigen 2, NG2),结果显示激光处理后没有显著性差异(图5c-e)。
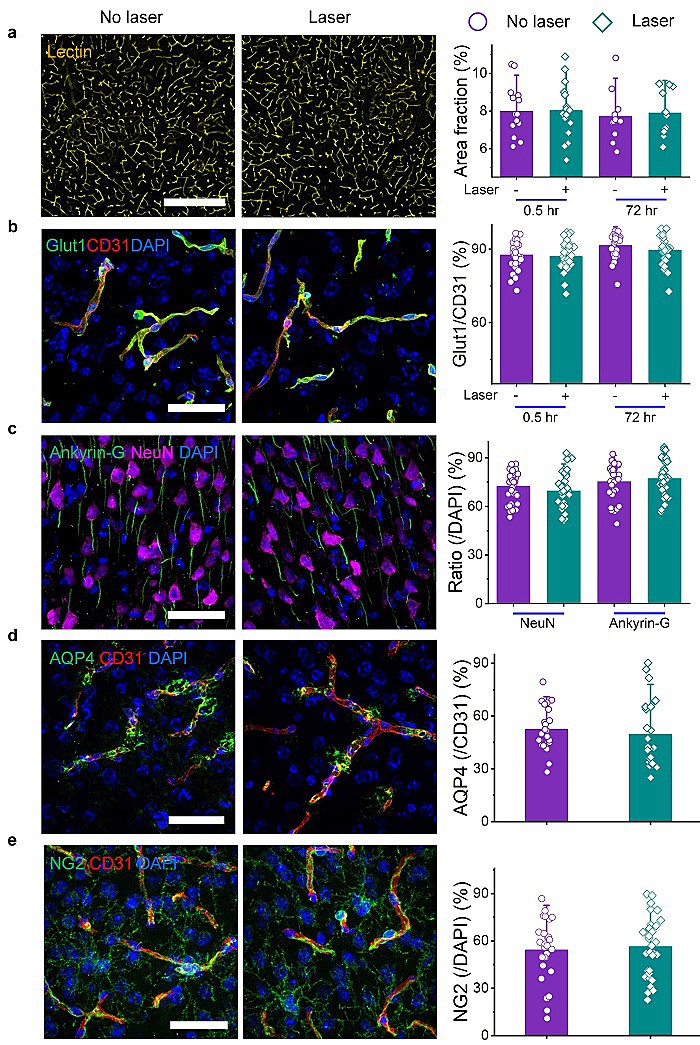
图5. 打开BBB没有影响脑血管密度和脑组织的细胞架构。(a)西红柿生物素标记脑血管。(b)免疫组化标记血管上葡萄糖转运体(Glut1)。(c-e)免疫组化检测脑细胞上的蛋白:神经元核蛋白(NeuN)和轴突初始段蛋白(Ankyrin-G)(c)、星形胶质细胞足突上的水分子转运体(AQP4)( d)、周细胞的神经胶质抗原2(neural glial antigen 2, NG2)(e)。
最后,该团队证实了这个技术可以实现高效传送模型药物到脑实质里面,比如典型的药物:抗体IgG(14 nm),基因治疗载体AAV (26 nm),以及药物载体脂质体(80 nm)(图6)。
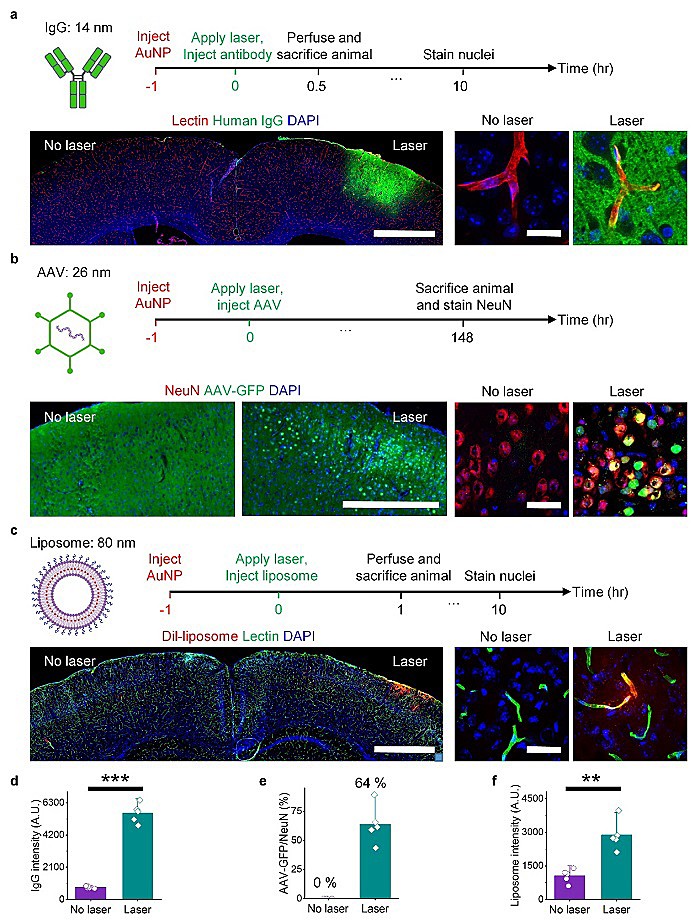
图6. BBB 渗透性增加实现抗体,基因治疗载体和脂质体的递送。(a)人抗体的递送。(b)基因治疗载体AAV的递送。(c)脂质体的递送。(d-f)抗体,AAV和脂质体的定量和统计学分析。
综上所述,通过该技术可逆打开血脑屏障具有非侵入性、高时间-空间分辨率的特点,并且在小鼠大脑中成功实现了模型药物的递送,因此在中枢神经系统疾病的治疗中具有广泛的应用前景。
这一成果近期发表在Nano Letters 上。文章的共同第一作者是德克萨斯大学达拉斯校区的博士生李小青和博士后蔡琪,以及德克萨斯大学西南医学中心的病理学家Vamsidhara Vemireddy,通讯作者是秦真鹏教授和Robert Bachoo 教授。该研究得到了Cancer Prevention & Research Institute of Texas (CPRIT) 等机构的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Reversibly Modulating the Blood–Brain Barrier by Laser Stimulation of Molecular-Targeted Nanoparticles
Xiaoqing Li#, Vamsidhara Vemireddy#, Qi Cai#, Hejian Xiong, Peiyuan Kang, Xiuying Li, Monica Giannotta, Heather N. Hayenga, Edward Pan, Shashank R. Sirsi, Celine Mateo, David Kleinfeld, Chris Greene, Matthew Campbell, Elisabetta Dejana, Robert Bachoo*, and Zhenpeng Qin*
Nano Lett., 2021, DOI: 10.1021/acs.nanolett.1c02996
导师介绍
秦真鹏
https://www.x-mol.com/university/faculty/90994
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号