新加坡科学家解析新冠病毒RNA二级结构与病毒-宿主RNA相互作用,揭示病毒逃避宿主免疫的潜在机制
根据世界卫生组织(WHO)统计,截至2021年8月新冠肺炎大爆发造成全球超过2.14亿人感染,440万人死亡。至今确诊与死亡人数还在持续增加中,造成全球经济以及社会的巨大冲击。新型冠状病毒(SARS-CoV-2)是全球疫情大爆发的罪魁祸首。新冠病毒是单链RNA病毒,它的RNA基因组不仅承载遗传信息,同时具有重要的调控功能。值得注意的是SARS-CoV-2的大多数分子病毒学研究都集中在病毒蛋白以及病毒RNA与宿主蛋白的互作上,极少数着重于探讨病毒RNA与宿主RNA之间的相互作用。填补这一空缺,不仅可以了解新冠病毒的感染与调控过程,还能有助于针对其RNA的结构开发更有效的药物。
近日,新加坡ASTAR基因组研究所 (GIS) 万月课题组、生物信息研究所 (BII) Roland Huber课题组与杜克-新加坡国立大学医学院王林发课题组合作,使用多种RNA分子结构探测方法以及RNA-RNA相互作用分析技术,解析了新冠病毒基因组RNA的二级结构信息和病毒-宿主之间的RNA相互作用;同时发现在新型冠状病毒基因组RNA上广泛存在2’-O-methylation修饰, 推测可能有助于新冠病毒逃避宿主免疫攻击。该研究成果近日发表于Nature Communications 杂志上1,并受到新加坡《海峡时报》 (The Strait Times) 的关注。
RNA结构是RNA的调控与功能的基础。运用传统的结构生物学方法包括X射线晶体衍射、NMR、冷冻电镜等,已经解析了例如核糖体、剪接体等RNA三维结构;但是由于RNA结构相对蛋白质更加灵活多变,传统结构生物学方法存在诸多局限,也不能在细胞环境下获得高通量的RNA结构信息。随着二代测序技术的发展,结合化学修饰与高通量测序开发了许多高通量探测全转录组RNA二级结构的技术,并应用于RNA结构以及RNA相关调控与功能研究中,揭示出RNA结构在调控和功能中的广泛作用。新加坡基因组研究所万月课题组一直致力于开发RNA结构研究的方法, 之前已经开发了基于Proximate Ligation的RNA-RNA互作研究方法SPLASH2和基于第三代测序技术牛津纳米孔测序和化学标记的RNA全长二级结构探测方法PORE-Cupine3,并将这些技术应用在了登革热病毒和寨卡病毒等RNA病毒的二级结构和功能元件研究中。
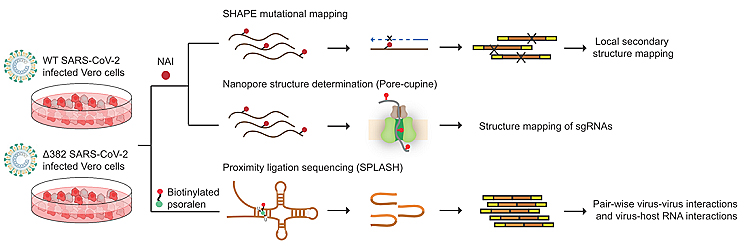
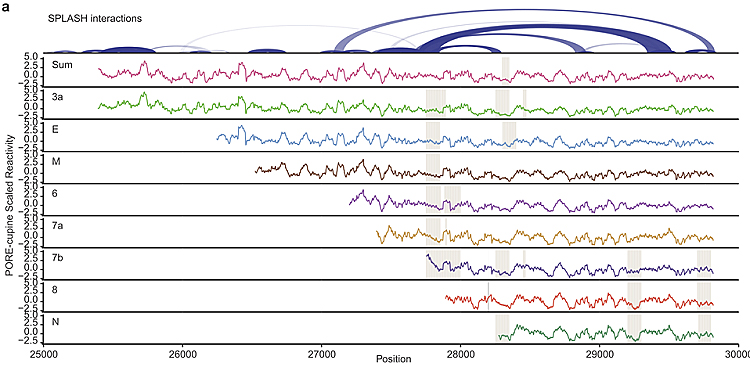
研究者运用基于化学标记和高通量测序的SHAPE-MaP和PORE-Cupine的方法揭示了新冠病毒基因组RNA的二级结构,通过结构分析找出潜在的保守结构元件和调控位点。新冠病毒除了基因组RNA以外还能产生亚基因组RNA (subgenomic RNAs, sgRNAs),sgRNAs的转录对病毒RNA的复制起关键作用。sgRNAs与基因组RNA重复的部分序列相同,传统测序手段无法分辨,而PORE-Cupine技术可以获得全长RNA的序列以及其二级结构,能成功分辨出具有相同部分序列的sgRNAs及其个别结构。因此该研究在检测基因组RNA的二级结构的同时也检测了個別sgRNAs的二级结构,发现基因组RNA和sgRNAs大部分二级结构相似,但也存在sgRNAs特异的二级结构。此外,该研究还使用了SPLASH对新冠病毒基因组RNA的分子内折叠以及分子间相互作用进行分析,研究发现新冠病毒基因组RNA中存在大量可变的分子间折叠和相互配对,超过50%的配对位点存在两种或以上的配对方式,推测新冠病毒基因组RNA在宿主细胞中可能存在多种不同的二级结构,对应不同的时期或调控状态。
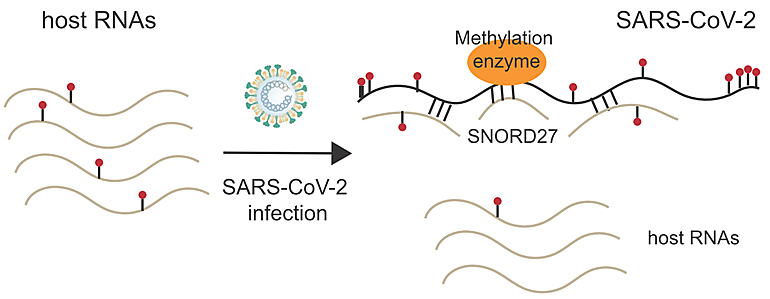
新冠病毒基因组RNA中除了可以产生自身折叠和配对外,还可以和宿主RNA发生相互作用。细胞核小RNA (snoRNA) 是一类非编码小RNA分子,通过分析RNA互作结果发现一个名为SNORD27的宿主snoRNA与新冠病毒基因组RNA存在极强的相互作用;在新冠病毒感染的细胞中SNORD27的表达量与未感染新冠病毒的细胞相比显著升高约6倍。已有研究结果显示SNORD27与RNA核糖2号位甲基化修饰 (2′-O-methylation, 2’-OM) 密切相关。为此该研究运用基于高通量测序的2′-O-methylation检测方法Nm-Seq,发现在新型冠状病毒基因组RNA上广泛存在2’-O-methylation修饰,其分布密度远远大于宿主转录组中的2’-O-methylation修饰的密度。该研究也指出相较于未感染的宿主細胞,被新冠病毒感染的细胞2’-O-methylation修饰程度显著下降,推测SNORD27与病毒RNA的交互作用有利於病毒‘骑劫’宿主细胞内的2’-O-methylation修饰机制,促使病毒2’-O-methylation修饰程度增加,进而提高其RNA的稳定性, 同时减低宿主RNA的修饰并促进其降解。先前对艾滋病病毒HIV的研究显示2’-O-methylation修饰可以帮助病毒逃脱宿主的免疫攻击4,由此推测新冠病毒可能也是采取相似的机制躲避宿主免疫。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Comprehensive mapping of SARS-CoV-2 interactions in vivo reveals functional virus-host interactions
Siwy Ling Yang, Louis DeFalco, Danielle E. Anderson, Yu Zhang, Jong Ghut Ashley Aw, Su Ying Lim, Xin Ni Lim, Kiat Yee Tan, Tong Zhang, Tanu Chawla, Yan Su, Alexander Lezhava, Andres Merits, Lin-Fa Wang, Roland G. Huber & Yue Wan
Nat. Commun., 2021, 12, 5113, DOI: 10.1038/s41467-021-25357-1
参考资料:
1. Aw, Jong Ghut A. et al. In vivo Mapping of Eukaryotic RNA Interactomes Reveals Principles of Higher-Order Organization and Regulation. Molecular Cell, 62, 603-617, doi: 10.1016/j.molcel.2016.04.028 (2016).
2. Aw, J. G. A. et al. Determination of isoform-specific RNA structure with nanopore long reads. Nature Biotechnology, doi: 10.1038/s41587-020-0712-z (2020).
3. Ringeard, M., Marchand, V., Decroly, E., Motorin, Y. & Bennasser, Y. FTSJ3 is an RNA 2’-O-methyltransferase recruited by HIV to avoid innate immune sensing. Nature, 565, 500-504, doi: 10.1038/s41586-018-0841-4 (2019).
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号