王文元/徐俊/王坚团队Nat. Commun.:脑特异性lncRNA参与调控神经细胞DNA损伤修复新机制
注:文末有研究团队简介及本文科研思路分析
DNA损伤修复功能的减弱是细胞、器官和生命个体衰老的主要因素之一。近年的研究提示在众多神经退行性疾病患者的脑组织切片中都发现了损伤DNA的积累。神经细胞(神经元)是终末分化的细胞,没有增殖能力,是人体内寿命最长的细胞类型(理论上讲,神经元的寿命和我们人的寿命是一样长的),所以DNA损伤修复的能力和基因组稳定性对神经元功能维持尤其重要。
近日,中国科学院生物与化学交叉研究中心王文元/同济大学徐俊/华山医院王坚团队在Nature Communications 上在线发表研究文章,首次报道并命名了一个新的大脑特异性非编码核糖核酸(lncRNA)BS-DRL1,并且揭示了其参与调控神经细胞DNA损伤应答和基因组稳定性的机制。
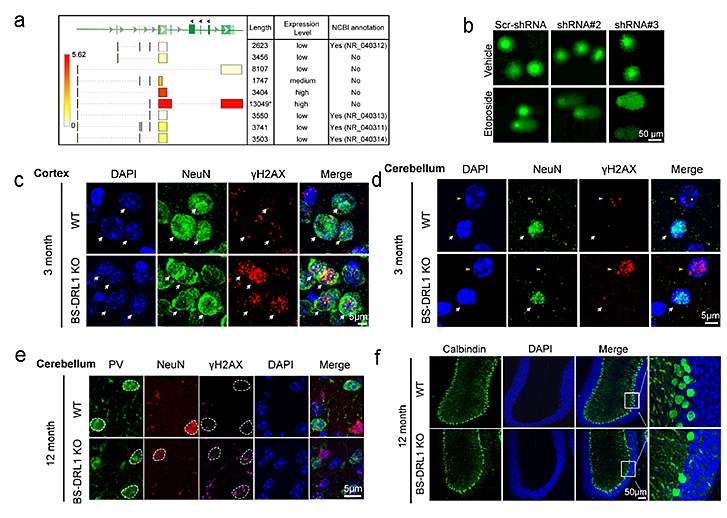
体内体外实验表明,BS-DRL1的缺失会使原代培养的神经细胞,小鼠大脑皮层及小脑中浦肯野细胞在损伤诱导下积累更多的损伤DNA(附图a-d)。且未修复的DNA损伤在生理条件下也会随着小鼠年龄的增加而积累(附图e),进而造成特定神经细胞随着衰老渐进性死亡(附图f)。
该工作详细阐述了BS-DRL1的作用机制:一方面在DNA损伤应答早期,BS-DRL1和HMGB1以相反的作用机制,相互制约早期响应蛋白的磷酸化水平,使其在一个正常范围内;另一方面,在损伤修复阶段,BS-DRL1作为支架蛋白,招募相关蛋白到损伤位点进行修复,从而维持基因组的稳定性。该研究揭示长链非编码RNA在神经系统中参与调控DNA损伤应答并影响衰老相关表型。
上述工作由中科院上海有机所生物与化学交叉研究中心王文元研究员、同济大学附属上海东方医院徐俊教授和复旦大学附属华山医院王坚教授为共同通讯作者,中科院上海有机所生物与化学交叉研究中心博士生娄敏敏、唐晓强和同济大学医学院附属同济医院博士后汪光明为共同第一作者。该研究由国家自然科学基金委,科技部重大专项和上海市高峰人才团队专项资金支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Long noncoding RNA BS-DRL1 modulates the DNA damage response and genome stability by interacting with HMGB1 in neurons
Min-Min Lou, Xiao-Qiang Tang, Guang-Ming Wang, Jia He, Fang Luo, Ming-Feng Guan, Fei Wang, Huan Zou, Jun-Ying Wang, Qun Zhang, Ming-Jian Xu, Qi-Li Shi, Li-Bing Shen, Guo-Ming Ma, Yi Wu, Yao-Yang Zhang, Ai-bin Liang, Ting-Hua Wang, Liu-Lin Xiong, Jian Wang, Jun Xu & Wen-Yuan Wang
Nat. Commun., 2021, 12, 4075, DOI: 10.1038/s41467-021-24236-z
王文元博士简介

王文元,2014年中组部“海外引进人才”,中国科学院生物与化学交叉研究中心研究员,课题组长,复旦大学附属华山医院双聘教授。发表论文20余篇,总引3000余次(单篇最高引用860余次)。
王文元研究员的研究方向为利用诱导性干细胞、3D培养类脑、小鼠模型和Crispr/Cas9基因编辑等技术进行中枢神经系统疾病发病机理和诊疗新方法的研究开发。研究目标是建立实用疾病模型,在不同层面上系统地对AD、ALS和FTD等脑疾病的分子细胞机制进行详细深入的研究,并寻找可行的治疗靶点。
科研思路分析
Q:这项研究的最初想法是怎么产生的?
A:其实这项研究最初想法来自于王文元研究员发表的关于FUS参与调控DNA损伤的研究“Interaction of FUS and HDAC1 regulates DNA damage response and repair in neurons”,FUS作为一种RNA 结合蛋白 ,我们希望找到与其结合的长链非编码RNA(lncRNA),并参与到神经细胞DNA损伤,因此我们利用HITS-CLIP技术进行筛选。实验结果显示FUS虽然与lncRNA BS-DRL1相结合,但细胞的损伤水平不影响其与BS-DRL1的结合,因此我们结合in-house 数据库和已发表的公开数据库重新筛选在神经系统高表达且在人和鼠两个物种相对保守的lncRNA,发现BS-DRL1既满足这两个筛选表标准又参与到原代培养的神经元DNA损伤,同时我们还鉴定到几个新的且在神经元也特异性高表达的转录本,因此我们对其进行了详细的机制研究。
Q:研究过程中有遇到哪些难点?
A:在进行下游机制研究时,该lncRNA(BS-DRL1)的缺失和其结合蛋白HMGB1的缺失造成的细胞损伤表型(γH2AX)是相反的,但细胞整体DNA 链断裂又都是增加的(彗星实验)。这个问题最初也很困扰我们,经过多种分子实验包括非同源末端连接(NHEJ)修复通路上游蛋白磷酸化水平检测,NHEJ 报告系统实验结果表明,BS-DRL1在神经细胞DNA损伤中发挥了两方面的作用,更加完善了其作用机制。其次,BS-DRL1与HMGB1的共标也是一大难点,受限于技术本身,在BS-DRL1染色时需要先用蛋白酶处理样品,导致lncRNA与互作蛋白共标困难,但我们也通过几种分子实验(CHIRP-MS, RIP, CHIP-qPCR等)证明其相互作用。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号