Nano Lett.┃石墨炔与细胞内蛋白冠重要组分STAT3互作调控肿瘤免疫微环境
英文原题:The Underlying Function and Structural Organization of the Intracellular Protein Corona on Graphdiyne Oxide Nanosheet for Local Immunomodulation

通讯作者:蔡绒,陈春英,国家纳米科学中心
作者:Mengyu Guo, Lina Zhao, Jing Liu, Xiaofeng Wang, Haodong Yao, Xueling Chang, Ying Liu, Jiaming Liu, Min You, Jiayu Ren, Fuhui Wang, Liming Wang, Yaling Wang, Huibiao Liu, Yuliang Li, Yuliang Zhao, Rong Cai, Chunying Chen
纳米材料/纳米药物进入生命体系后,将面对复杂的生理环境,与周围的生物流体或生物分子(蛋白质、DNA和脂质)发生相互作用。纳米材料-生物界面的相互作用是决定其生物效应的核心步骤。
肿瘤相关巨噬细胞TAM是多种肿瘤间质中数目最多的炎性细胞群,促进肿瘤的生长、转移及复发,诱导免疫抑制,与实体瘤预后不良相关。针对肿瘤相关巨噬细胞主要有三种治疗方法:抑制巨噬细胞的招募,直接杀伤TAM以及TAM重编程(以M1极化为主)。目前,多种小分子药物已被用于临床实验,但是小分子缺乏靶向性,实体瘤复杂的微环境也在一定程度上限制了这些小分子药物的疗效。纳米材料由于其多样的物理和化学性质既可以用作递送载体,也可以用作免疫调节剂,改善肿瘤免疫抑制微环境。纳米材料本身引起极化的研究主要包括碳材料、氧化铁纳米颗粒、Au颗粒、ZnO颗粒等。
二维碳纳米材料是一类片状纳米材料,具有较大的比表面积,独特的表面化学性质,在癌症治疗领域有着广泛应用,包括作为药物载体,具有较高的载药率,利用近红外吸收进行光热治疗等。石墨炔是一种新兴的二维碳材料,具有独特的sp和sp2碳原子以及高度的π共轭结构,在催化、能源、生物医药等领域均展现出广阔的应用前景。
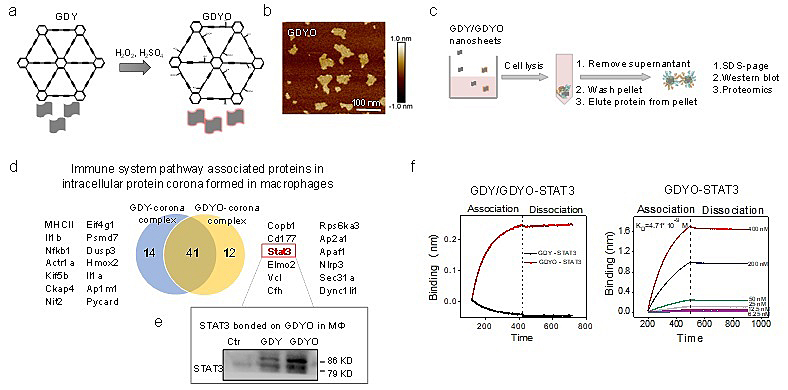
图1. GDY及GDYO表面蛋白冠的分析表征。a) GDY及GDYO结构示意图。b) GDYO AFM表征图。c) GDY/GDYO 处理后的巨噬细胞裂解物进行SDS-PAGE,蛋白质电泳和蛋白质组学分析。d) LC-MS/MS分析GDY及GDYO表面结合的免疫相关蛋白。e) GDY/GDYO表面蛋白冠中STAT3蛋白电泳分析。f) GDY/GDYO与STAT3蛋白的吸附,解吸附曲线。
近日,国家纳米科学中心陈春英研究员(点击查看介绍)通过蛋白质组学以及同位素标记定量的方法,首次发现在巨噬细胞内氧化石墨炔(GDYO)表面形成独特的蛋白冠,其中高度富集信号传导与转录激活因子(STAT3)蛋白。STAT3蛋白转运入核后激活靶基因转录,促进巨噬细胞发生M2极化进而促进肿瘤的发生发展。GDYO-STAT3相互作用影响了肿瘤相关巨噬细胞表型,使其由促进肿瘤的M2型逆转为抑制肿瘤的M1型,改善了肿瘤微环境的免疫抑制,提升了免疫检查点疗法的疗效。
本文首次利用同位素13C对GDYO进行骨架标记,定量分析了GDYO与细胞内蛋白的互作比例。同时分析了给药后GDYO在腹腔巨噬细胞及肿瘤内的分布及代谢,为碳纳米材料在体内生物行为的评估提供了直接、准确、定量的分析方法。
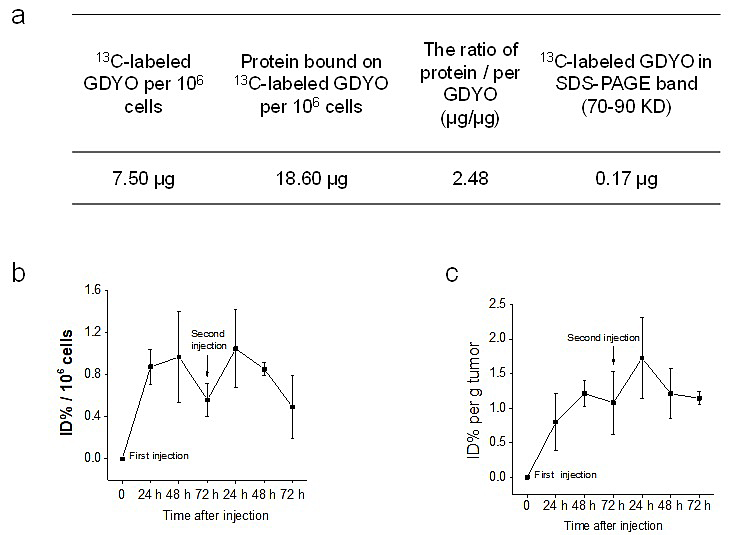
图2. a) 利用同位素13C标记GDYO检测其与蛋白吸附比例。13C标记GDYO在腹腔巨噬细胞b)及肿瘤c)的分布。
GDYO独特的sp和sp2碳原子和高度的π共轭结构,以及表面的氧化基团C–OH及C=O,影响其与生物分子之间的相互作用。GDYO与STAT3蛋白的作用同时取决于GDYO的表面化学与STAT3蛋白的二级结构及序列,由结构匹配、氢键和盐桥驱动。两个临近的C=O和/或C-OH基团的距离为5.5 Å。STAT3蛋白N端domain中的α-helix的螺距为5.4 Å,与含氧基团的距离相匹配。进而,C=O及C-OH基团与STAT3蛋白中的氨基酸残基形成氢键或盐桥。
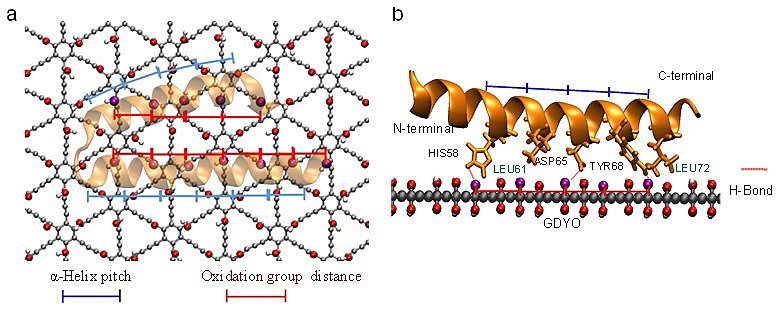
图3. GDYO-STAT3 界面的强相互作用是由结构匹配、氢键和盐桥的形成驱动的。 STAT3 α-螺旋的螺距约等于GDYO 中相邻氧化基团之间的距离。a) GDYO与STAT3结合俯视图。b) 侧视图。
水分子一方面与GDYO表面的含氧基团形成氢键,同时与STAT3蛋白的残基形成氢键(例如GLN212残基),在GDYO与蛋白之间建立“水桥”,促进GDYO与STAT3蛋白的相互作用。
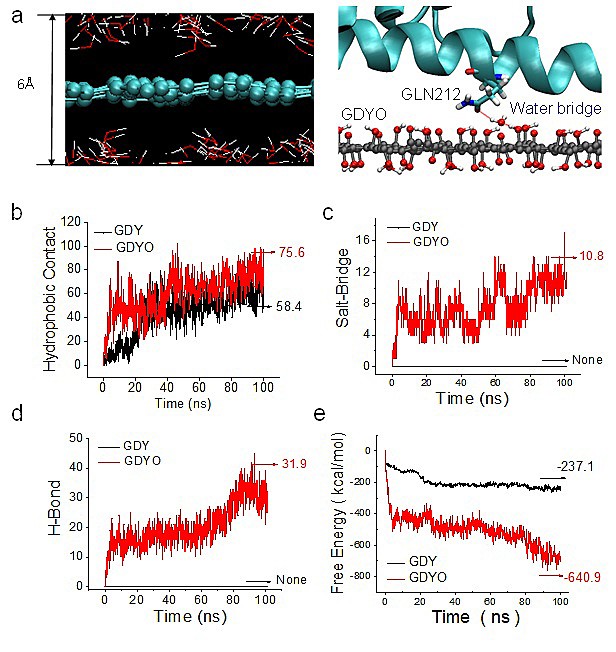
图4. a) GDYO表面水分子分布以及GDYO与STAT3之间水桥的形成。b-e) GDY/GDYO与STAT3之间疏水作用力、盐桥、氢键、自由能的计算。
通过抑制STAT3蛋白的激活,GDYO逆转免疫抑制M2型巨噬细胞为促炎M1型巨噬细胞。在黑色素瘤模型中,GDYO可以显著逆转瘤内TAMs表型,改善TAMs引起的免疫抑制,增加杀伤性T细胞浸润及激活,提高PD-L1抗体的疗效。
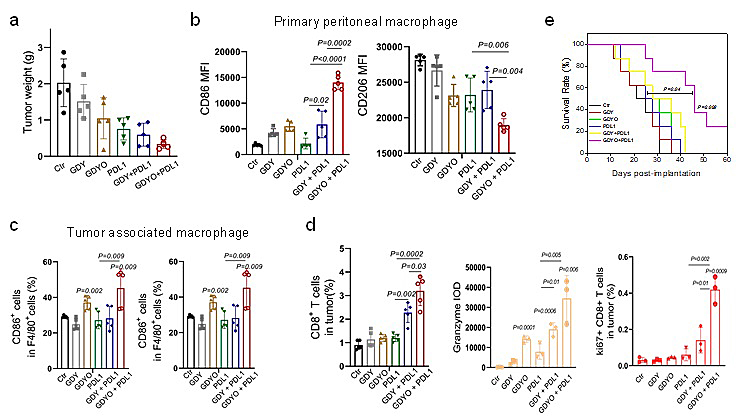
图5. GDY/GDYO提升PDL1抗体疗效。a) 肿瘤重量。b, c) 腹腔及肿瘤内巨噬细胞表型变化。d) 肿瘤内CD8+ T细胞比例及相关表型变化。
本文利用二维碳基纳米材料实现了基于TAMs的肿瘤免疫抑制微环境调控,为更广泛的免疫联合治疗提供了新的思路。该研究综合运用蛋白组学,高性能理论计算的分子机制解析以及同位素定量技术,首次揭示了巨噬细胞内纳米颗粒-蛋白质界面的相互作用机制,对于深入理解纳米-生物界面调控纳米材料复杂生物学效应提供了新认识。
相关论文发表在Nano Letters 上,国家纳米科学中心特别研究助理郭梦雨,中科院高能物理研究所赵丽娜研究员及国家纳米科学中心刘晶研究员为文章的第一作者,国家纳米科学中心蔡绒副研究员和陈春英研究员为通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

The Underlying Function and Structural Organization of the Intracellular Protein Corona on Graphdiyne Oxide Nanosheet for Local Immunomodulation
Mengyu Guo, Lina Zhao, Jing Liu, Xiaofeng Wang, Haodong Yao, Xueling Chang, Ying Liu, Jiaming Liu, Min You, Jiayu Ren, Fuhui Wang, Liming Wang, Yaling Wang, Huibiao Liu, Yuliang Li, Yuliang Zhao, Rong Cai*, and Chunying Chen*
Nano Lett., 2021, 21, 6005–6013, DOI: 10.1021/acs.nanolett.1c01048
Publication Date: July 9, 2021
Copyright © 2021 American Chemical Society
(本稿件来自ACS Publications)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!










































 京公网安备 11010802027423号
京公网安备 11010802027423号