人核糖核酸酶1作为ephrin A4 受体的分泌性配体并诱导乳腺肿瘤发生
癌症干细胞,又被称作肿瘤起始细胞,是肿瘤细胞中具备类似干细胞性质的特定族群,具有自我更新与细胞分化等能力,进而驱动肿瘤生长和异质性。另外,癌症干细胞的高度可塑性特征导致肿瘤细胞发展出更具侵略性的转移和复发,或产生无法靶向的耐药性群体。因此,如何调控癌症干细胞在恶性肿瘤的发生与演进过程,一直是临床癌症治疗上研究的主要课题之一。近日,台湾中国医药大学校长洪明奇教授带领的国际团队发现人类核糖核酸酶1(human ribonuclease 1; hRNase 1)在乳腺癌肿瘤干细胞的调控上扮演重要的角色。
根据洪教授团队近年来的研究显示,人类核糖核酸酶家族除了具有降解核糖核酸的传统催化酶功能外,还拥有另一项与催化酶活性无关的配体 (ligand) 功能,其可与细胞膜上特定的受体酪氨酸激酶 (receptor tyrosine kinase; RTK) 膜蛋白结合,并活化此受体以及其下游信号传导通路。在本项最新研究证实,高表达的hRNase 1可增加乳腺癌干细胞的族群数量,并增强了乳腺癌细胞的肿瘤起始能力,而此过程并不需要hRNase 1催化核糖核酸活性的参与。为了更进一步寻找hRNase 1在细胞膜上未知的受体膜蛋白,团队利用一套无偏见的磷酸化受体酪氨酸激酶抗体数组的分析,再加上后续一系列生化实验的验证,证明了分泌至胞外环境的hRNase 1可作用为细胞膜上受体酪氨酸激酶EphA4的配体,藉由与受体EphA4结合促进EphA4磷酸化,并透过胞饮作用进入细胞内传递EphA4下游信号,进一步增加乳腺癌肿瘤干细胞族群的比例与肿瘤起始能力,以及促进肿瘤发生;反之,若利用基因敲除技术或专一抑制剂阻断两者之间的相互作用,则明显减少乳腺癌干细胞的生成能力并减缓肿瘤进展。这些结果清楚证实了hRNase 1可藉由专一的配体-受体 (ligand-receptor) 对应关系与EphA4结合,正向地参与乳腺癌肿瘤干细胞的调控机制。此外,经由对乳腺肿瘤病人组织微数组的病理分析,显示hRNase 1与EphA4活化程度或癌症干细胞标记CD133之间,呈现有意义正相关的统计结果,为本次研究在临床上的相关性提供了有力的支持证据。值得一提的是,hRNase 1在乳腺癌患者族群的血清样本中比健康个体族群有明显较高的表现量,显示hRNase 1极有潜力作为一个非侵入性血清生物标记,以精准医疗的概念协助乳腺癌患者评估是否选择使用EphA4标靶治疗。
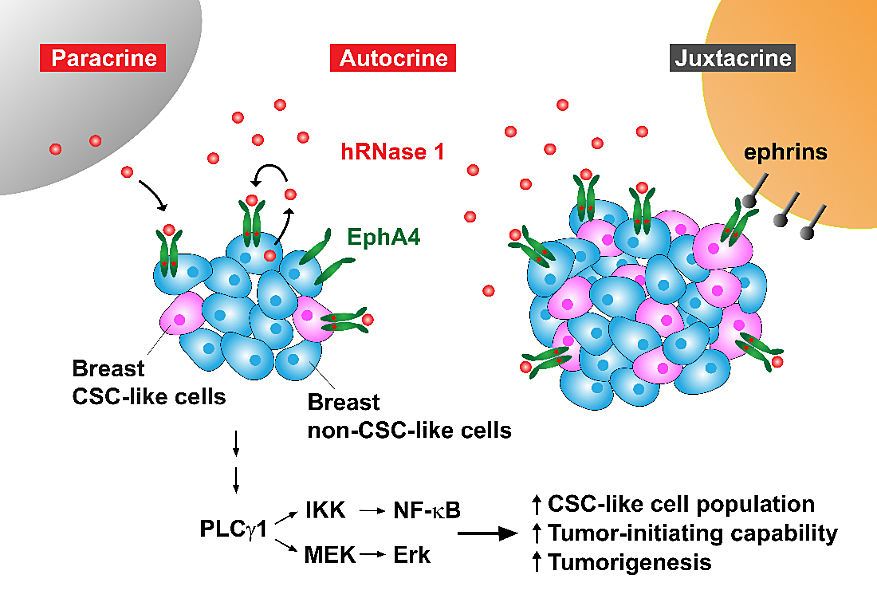
图1. hRNase 1作为EphA4膜蛋白的分泌性配体增加乳腺癌肿瘤干细胞的生成。图片来源:Nat. Commun.
总体而言,洪教授团队揭示了hRNase 1的一个全新面貌,除了为基础科学研究上提供了一个新颖的发展方向探讨核糖核酸酶家族作为配体而调节特定细胞膜蛋白受体外,也为将来临床癌症病人在治疗上提供了藉由阻断hRNase 1-EphA4活化途径而抑制乳腺癌干细胞生成的策略。此一崭新的乳腺癌治疗方向,将来或可结合现行的癌症疗法,例如化学治疗、靶向治疗、免疫疗法,以期增加乳腺癌治疗的有效率,并同时降低肿瘤细胞可能产生的抗药性。
这一成果近期发表在 Nature Communications 上,文章的第一作者是美国德州大学安德森癌症中心李恒焕与王盈乃老师,以及台湾中国医药大学杨文豪老师。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Human ribonuclease 1 serves as a secretory ligand of ephrin A4 receptor and induces breast tumor initiation
Heng-Huan Lee#, Ying-Nai Wang#, Wen-Hao Yang#, Weiya Xia, Yongkun Wei, Li-Chuan Chan, Yu-Han Wang, Zhou Jiang, Shouping Xu, Jun Yao, Yufan Qiu, Yi-Hsin Hsu, Wei-Lun Hwang, Meisi Yan, Jong-Ho Cha, Jennifer L. Hsu, Jia Shen, Yuanqing Ye, Xifeng Wu, Ming-Feng Hou, Lin-Ming Tseng, Shao-Chun Wang, Mei-Ren Pan, Chin-Hua Yang, Yuan-Liang Wang, Hirohito Yamaguchi, Da Pang, Gabriel N. Hortobagyi, Dihua Yu, Mien-Chie Hung*
Nat. Commun., 2021, 12, 2788. DOI: 10.1038/s41467-021-23075-2
繁體中文版本
癌症幹細胞,又被稱作腫瘤起始細胞,為腫瘤細胞中具備類似幹細胞性質的特定族群,具有自我更新與細胞分化等能力,進而驅動腫瘤生長和異質性。另外,癌症幹細胞的高度可塑性特徵導致腫瘤細胞發展出更具侵略性的轉移和復發,或產生無法靶向的耐藥性群體。因此,如何調控癌症幹細胞在惡性腫瘤的發生與演進過程,一直是臨床癌症治療上研究的主要課題之一。近日,台灣中國醫藥大學洪明奇校長帶領的國際團隊發現人類核糖核酸酶1號 (human ribonuclease 1; hRNase 1) 在乳癌腫瘤幹細胞的調控上扮演重要的角色。
根據洪校長團隊近年來的研究顯示,人類核糖核酸酶家族除了具有降解核糖核酸的傳統催化酶功能外,還擁有另一項與催化酶活性無關的配體 (ligand) 功能,其可與細胞膜上特定的受體酪氨酸激酶 (receptor tyrosine kinase; RTK) 膜蛋白結合,並活化此受體以及其下游訊息傳導通路。在本項最新研究證實,高表達的hRNase 1可增加乳癌幹細胞的族群數量,並增強了乳癌細胞的腫瘤起始能力,而此過程並不需要hRNase 1催化核糖核酸的活性參與。為了更進一步尋找hRNase 1在細胞膜上未知的受體膜蛋白,團隊利用一套無偏見的磷酸化受體酪氨酸激酶抗體陣列的分析,再加上後續一系列生化實驗的驗證,證明了分泌至胞外環境的hRNase 1可作用為細胞膜上受體酪氨酸激酶EphA4之配體,藉由與受體EphA4結合促進EphA4磷酸化,並透過胞飲作用進入細胞內傳遞EphA4下游訊號,進一步增加乳癌腫瘤幹細胞族群的比例與腫瘤起始能力,以及促進腫瘤發生;反之,若利用基因剔除技術或專一抑制劑阻斷兩者之間的相互作用,則明顯減少乳癌幹細胞的生成能力並減緩腫瘤進展。這些結果清楚證實了hRNase 1可藉由專一的配體-受體 (ligand-receptor) 對應關係與EphA4結合,正向地參與乳癌腫瘤幹細胞的調控機制。此外,經由對乳腺腫瘤病人組織微陣列的病理分析,顯示hRNase 1與EphA4活化程度或癌症幹細胞標記CD133之間,呈現有意義正相關的統計結果,為本次研究在臨床上的相關性提供了有力的支持證據。值得一提的是,hRNase 1在乳癌患者族群的血清樣本中比健康個體族群有明顯較高的表現量,顯示hRNase 1極有潛力作為一個非侵入性血清生物標記,以精準醫療的概念協助乳癌患者評估是否選擇使用EphA4標靶治療。
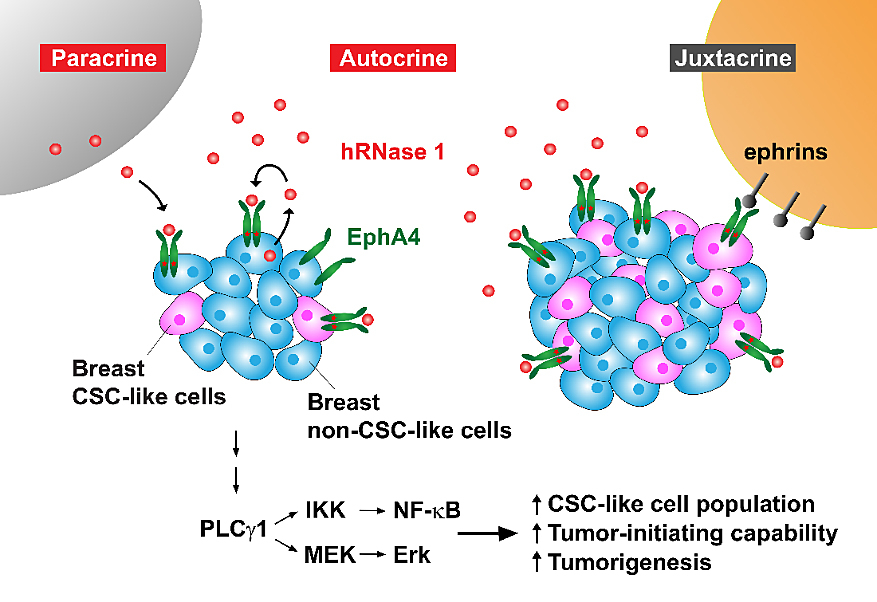
圖1. hRNase 1作為EphA4膜蛋白的分泌性配體增加乳癌腫瘤幹細胞的生成。圖片來源:Nat. Commun.
總體而言,洪校長團隊揭示了hRNase 1的一個全新面貌,除了為基礎科學研究上,提供了一個新穎的發展方向探討核糖核酸酶家族作為配體而調節特定細胞膜蛋白受體外,也為將來臨床癌症病人在治療上,提供了藉由阻斷hRNase 1-EphA4活化途徑而抑制乳癌幹細胞生成的策略。此一嶄新的乳癌治療方向,將來或可結合現行的癌症療法,例如化學治療、標靶治療、免疫療法,以期增加乳癌治療的有效率,並同時降低腫瘤細胞可能產生的抗藥性。
這一成果近期發表在 Nature Communications 上,文章的第一作者是美國德州大學安德森癌症中心李恆煥與王盈乃老師,以及台灣中國醫藥大學楊文豪老師。
原文(掃描或長按二維碼,識別後直達原文頁面,或点此查看原文):

Human ribonuclease 1 serves as a secretory ligand of ephrin A4 receptor and induces breast tumor initiation
Heng-Huan Lee#, Ying-Nai Wang#, Wen-Hao Yang#, Weiya Xia, Yongkun Wei, Li-Chuan Chan, Yu-Han Wang, Zhou Jiang, Shouping Xu, Jun Yao, Yufan Qiu, Yi-Hsin Hsu, Wei-Lun Hwang, Meisi Yan, Jong-Ho Cha, Jennifer L. Hsu, Jia Shen, Yuanqing Ye, Xifeng Wu, Ming-Feng Hou, Lin-Ming Tseng, Shao-Chun Wang, Mei-Ren Pan, Chin-Hua Yang, Yuan-Liang Wang, Hirohito Yamaguchi, Da Pang, Gabriel N. Hortobagyi, Dihua Yu, Mien-Chie Hung*
Nat. Commun., 2021, 12, 2788. DOI: 10.1038/s41467-021-23075-2
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号