“叶酸笼”-PROTACs策略精准降解癌细胞内靶蛋白
如今正受到药物研发领域极大关注的蛋白质水解靶向嵌合体(PROTAC)技术,原理是利用小分子劫持细胞内的E3泛素连接酶和泛素-蛋白酶体系统(UPS),介导靶标蛋白的降解。相对于小分子抑制剂,PROTAC技术有很多特有的优势,如可以降解所谓的“不可成药”的蛋白靶点(例如某些转录因子、骨架蛋白等),具有催化活性等。然而,限制PROTAC技术临床应用的一个制约因素是这些分子可能会降解某些正常组织或器官中的靶蛋白,导致对这些正常组织或器官的杀伤作用。克服这种潜在的毒副作用将会极大促进PROTAC技术的发展。
西奈山伊坎医学院的金坚教授课题组和哈佛医学院的魏文毅教授课题组长期致力于开发新型PROTAC技术,以及推进这些技术的临床应用。他们设想,与“前药”概念相似,如果预先将PROTAC分子保护起来,待其运输到目标部位,再采取一定的手段使活性PROTAC分子释放出来,就可以解决其可能杀伤正常组织的问题。遵循这一设想,2020年,他们合作开发了光响应的PROTAC技术(opto-PROTACs),实现了细胞水平上时空分辨性调控的蛋白靶向降解,极大地避免对正常细胞的损伤(Sci. Adv., 2020, 6, eaay5154)。光响应PROTAC技术具有显而易见的缺点,即只能对包括某些皮肤癌症在内的紫外光可及的肿瘤起到治疗作用。
叶酸受体α(FOLR1)可以选择性地将叶酸分子运输到细胞内,同时,由于其在多种肿瘤细胞膜上高表达而正常细胞膜很少甚至没有表达,因而被广泛应用于抗肿瘤药物的靶向递送。近日,金坚教授和魏文毅教授合作,借助FOLR1的特异性,构建了“叶酸笼”-PROTAC的策略(Folate-Caged PROTACs),实现PROTAC分子对肿瘤细胞的精准递送(图1)。
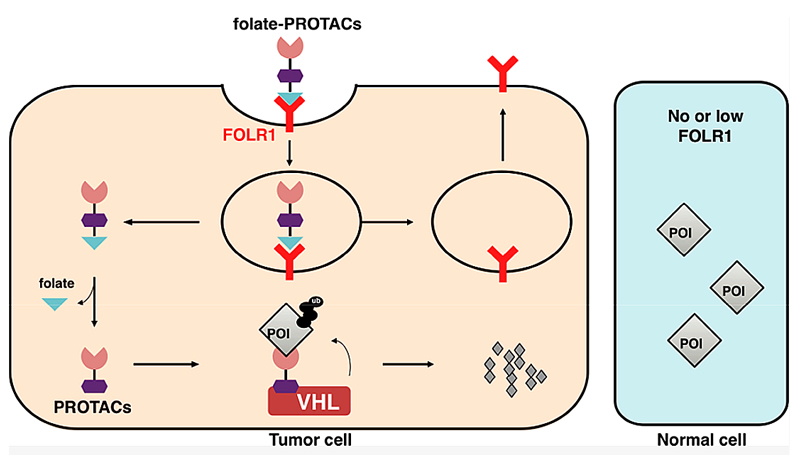
图1. folate-PROTAC选择性地降解肿瘤细胞中的靶蛋白。
如图2A所示为“叶酸笼”-PROTAC原理示意图。预先使用叶酸分子将E3连接酶VHL配体保护起来,以阻断PROTAC对靶蛋白的降解。待FOLR1将这种PROTAC运输到肿瘤细胞内之后,利用内源性水解酶切断叶酸和PROTAC之间的酯键,释放出PROTAC分子,以降解目标蛋白。
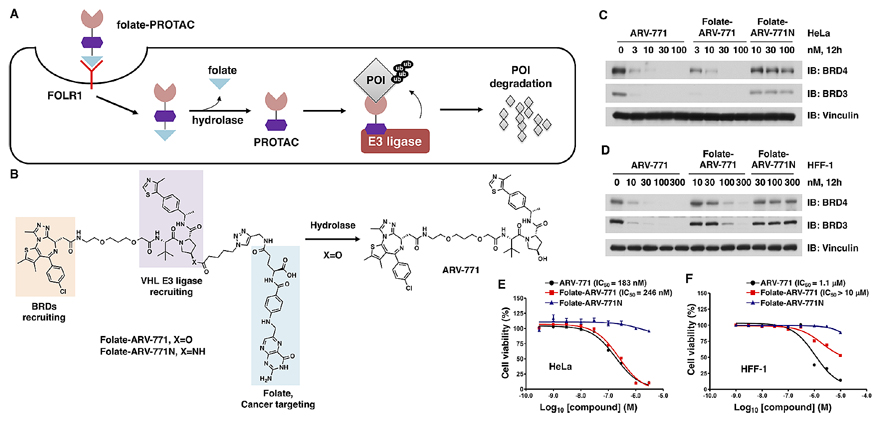
图2. FOLR1将folate-PROTAC递送进肿瘤细胞内并介导靶蛋白的降解。
ARV-771是一个被深入研究过的PROTAC分子,可以很高效地降解BRD蛋白。作者通过对其改造,合成了folate-ARV-771分子(图2B),包括三个部分:弹头,用于招募靶标蛋白BRD;VHL E3连接酶配体,用于招募VHL蛋白用于泛素化靶标蛋白;叶酸,用于靶向递送至肿瘤细胞。值得注意的是,当叶酸和VHL配体通过酰胺键连接时(folate-ARV-771N),水解酶不能切断叶酸分子,活性PROTAC不能在细胞内被释放出来。
对照实验表明(图2C-F),folate-ARV-771分子对癌细胞中BRD蛋白的降解是FOLR1依赖性的:在FOLR1高表达的HeLa细胞系中,folate-ARV-771与ARV-771具有相当的降解能力;在FOLR1低表达的正常细胞HFF-1细胞系中,folate-ARV-771对BRD蛋白的降解能力比AVR-771弱了许多;在这两种细胞系中,酰胺键连接的folate-ARV-771N分子均不能有效降解BRD蛋白。
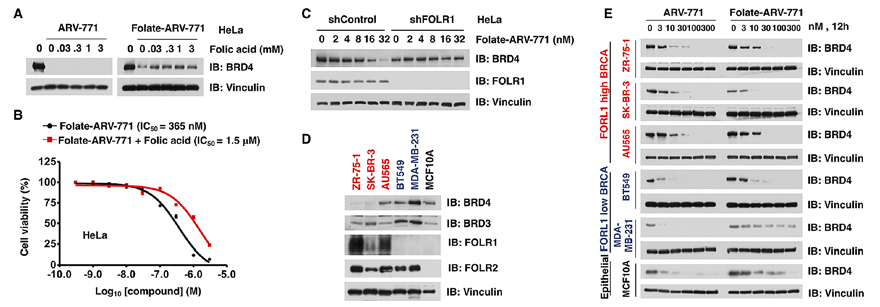
图3. folate-ARV-771对靶蛋白的降解具有FOLR1依赖性。
为了进一步验证folate-ARV-771对癌细胞的降解与叶酸受体FOLR1有关,作者分别利用游离的叶酸拮抗FOLR1、敲除FOLR1基因等手段证实了这个结论(图3A-C)。需要指出的是,在外加游离叶酸拮抗掉细胞表面的FOLR1时,由Western blot数据可以看到BRD蛋白并未被降解(图3A),但是folate-ARV-771仍然表现出了相当的细胞毒性(图3B)。可能是该分子因内吞作用进入细胞,而分子中的弹头部分抑制了BRD蛋白的活性,导致细胞死亡。另一方面,作者表征了folate-ARV-771对一系列具有不同FOLR1表达水平的BRCA细胞系的BRD蛋白的降解能力(图3D、3E),可以明显看到两者的正相关性,即FOLR1表达水平越高,BRD蛋白的降解效果越明显。
随后,作者基于本课题组发展的靶向MEK1/2和ALK蛋白的PROTACs(MS432和MS99),合成了另外两种folate-PROTAC,即folate-MS432和folate-MS99(图4),分别用于降解肿瘤细胞中的MEK1/2和ALK蛋白。与folate-ARV-771类似,它们均表现出了很强的FOLR1依赖性。表明“叶酸笼”策略具有普适性,能适用多种PROTAC的改造。
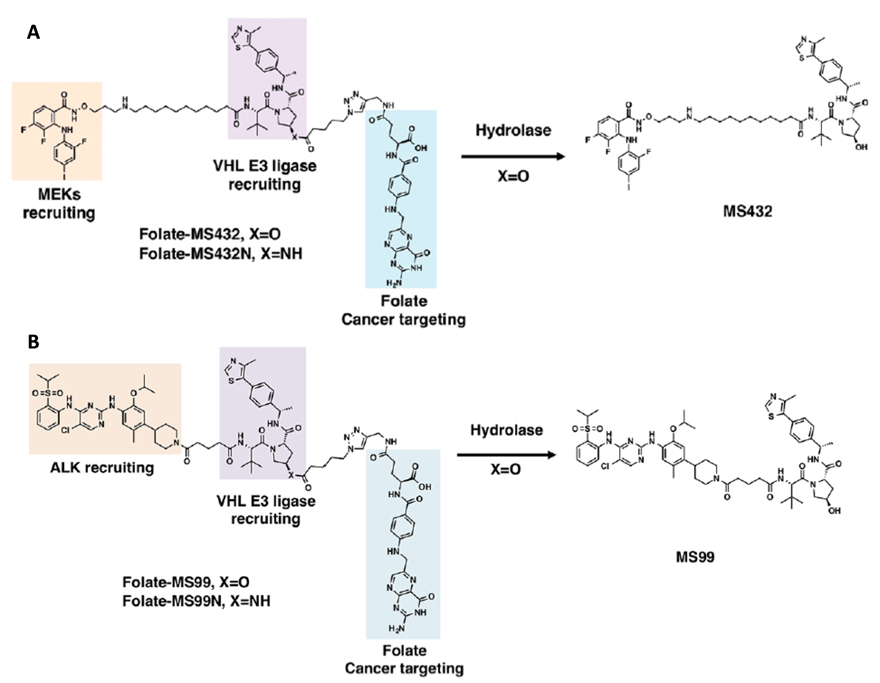
图4. folate-MS432和folate-MS99的分子结构。
综上所述,作者利用肿瘤细胞叶酸受体FOLR1高表达的特性,开发了一种新型PROTAC技术——folate-PROTAC,用于精准递送PROTAC,使其选择性地降解癌细胞内的目标靶点蛋白。该技术能有效地克服传统PROTAC分子在正常组织和细胞内降解靶蛋白而产生的毒副作用,具有广泛的普适性,被成功应用于三种不同靶点蛋白的PROTAC改造,极大促进了该领域的发展。这一成果近期发表在J. Am. Chem. Soc.上,共同第一作者为刘静博士和陈贺博士。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Cancer Selective Target Degradation by Folate-Caged PROTACs
Jing Liu, He Chen, Yi Liu, Yudao Shen, Fanye Meng, H. Ümit Kaniskan, Jian Jin*, and Wenyi Wei*
J. Am. Chem. Soc., 2021, 143, 7380–7387, DOI: 10.1021/jacs.1c00451
金坚教授简介

金坚,著名药物化学家, 美国西奈山医学院冠名教授,西奈山医疗发展中心主任, 西奈山伊坎医学院药理学系、肿瘤和神经科学系、帝势癌症研究所终身教授。本科毕业于中国科学技术大学;博士毕业于宾夕法尼亚州立大学,师从著名有机化学家Steven M. Weinreb。
金坚教授具有二十多年的小分子药物研发经验,在国际药物化学界享有盛誉。曾任葛兰素史克(GlaxoSmithKline)公司药物化学部门总监、北卡罗来纳大学教堂山分校药物化学部副主任等职。金坚教授课题组的研究方向主要为:(1)组蛋白甲基转移酶选择性抑制剂的发现;(2)G蛋白偶联受体偏向性配体的开发;(3)靶向肿瘤蛋白新型降解剂的研制。迄今为止已在相关领域发表近200篇SCI论文,包括Nature, Science, Cell, Nat. Med., Nat. Rev. Drug Discov., Nat. Biotechnology, Nat. Chem. Biol., Nat. Reviews Cancer, Cancer Cell, Nat. Cancer, J. Am. Chem. Soc., Angew. Chem. Int. Ed., Sci. Adv., Nat. Commun., J. Med. Chem.等;申请美国及国际专利60余项。
课题组主页:
https://labs.icahn.mssm.edu/jinlab/
魏文毅教授简介
魏文毅,著名肿瘤生物学家,美国哈佛医学院终身教授,本科毕业于山东大学;博士毕业于美国布朗大学,师从John M. Sedivy教授;后于丹娜-法伯癌症肿瘤研究所William Kaelin教授实验室从事博士后研究助理工作。
魏文毅教授团队长期致力于肿瘤生物学的细胞周期调控机制及Akt/mTOR的翻译后修饰研究。现已在Science,Nature,Cell,Cancer Cell,Nature Cell Biology, Cancer Discovery,Molecular Cell,Nature Reviews Cancer等杂志发表上150余篇论文,引用超过14000次。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号