上海中医药大学张卫东、栾鑫等JMC封面:溶瘤蜂毒肽构象锁定衍生物激活抗肿瘤免疫抑制黑色素瘤生长
注:文末有本文作者科研思路分析
溶瘤免疫疗法(oncolytic-immunotherapy)是一种新型肿瘤免疫治疗策略,能选择性杀伤肿瘤细胞,继而释放肿瘤相关抗原启动机体系统性抗肿瘤免疫。已有研究表明天然来源溶瘤肽(如蜂毒肽anoplin)可选择性裂解肿瘤细胞膜,且对耐药肿瘤依然有效,部分研究成果亦证明溶瘤肽具有潜在的激活机体抗肿瘤免疫的作用。然而这类天然多肽分子本身存在抗肿瘤活性弱、稳定性差等不足,严重限制了后续开发。近日,上海中医药大学交叉科学研究院张卫东及陈红专教授团队基于构象锁定订书肽策略,成功设计合成了系列蜂毒肽anoplin构象锁定衍生物(Stapled anoplin peptides, StAnos),深入开展其体内、外溶瘤作用评价,并阐明溶瘤蜂毒肽诱导肿瘤细胞免疫原性细胞死亡(immunogenic cell death, ICD),激活CD8+ T细胞介导的黑色素瘤溶瘤免疫作用的新机制(图1)。
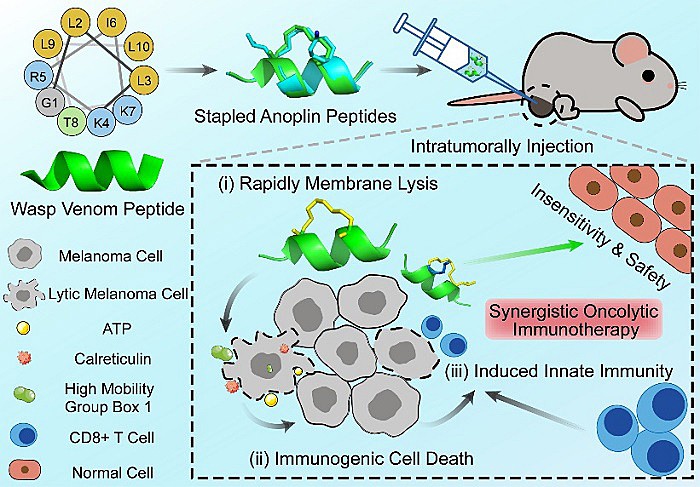
图1. StAnos的设计、合成及溶瘤免疫功能机制示意图
课题组前期在订书肽和天然细胞毒性肽领域已开展系列工作,本研究中通过全碳氢订书肽策略,成功合成11个StAnos。以恶性程度高且容易耐药的三阴性乳腺癌4T1细胞和黑色素瘤B16F10细胞为模型,对这些化合物进行初步的体外抗肿瘤活性评价,系统总结了构-效关系,发现了具有显著α-螺旋刚性、高效溶瘤作用和安全性较好的候选分子Ano-3(图2),其效果优于目前临床二期阳性溶瘤肽LTX-315。
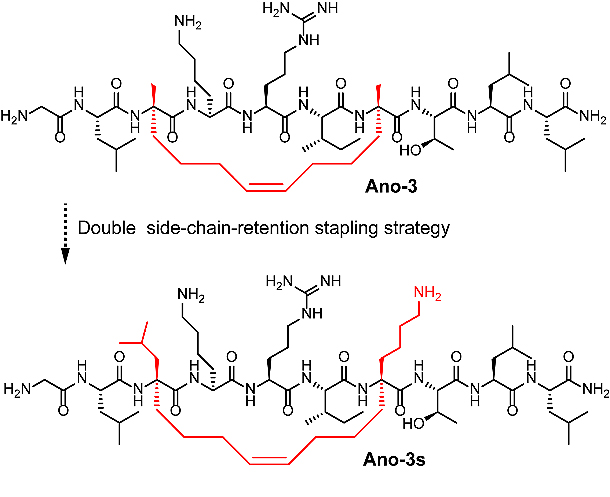
图2. Ano-3和Ano-3s的结构比较
在此基础上,针对Ano-3水溶性较差的不足,采用新型双侧链保留的多肽构象锁定技术合成其衍生物Ano-3s(图2)。体外抗肿瘤作用及初步成药性研究表明(图3),Ano-3s亦可通过快速裂解肿瘤细胞膜的作用,高效抑制体外肿瘤细胞增殖,抑瘤效果与Ano-3相当。值得注意的是,水溶性改善后的Ano-3s其溶血副作用进一步降低,且Ano-3和Ano-3s的耐蛋白酶水解能力均显著优于原型化合物Anoplin及阳性对照LTX-315。以上结果显示,Ano-3s有望成为后续研究的先导化合物。
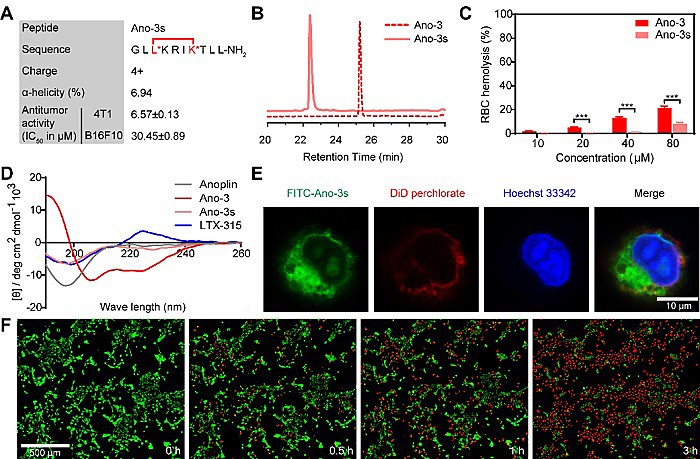
图3. Ano-3s的体外高选择性和快速溶瘤作用
体内抗肿瘤实验中,Ano-3和Ano-3s在黑色素瘤B16F10荷瘤小鼠中实现高效抑制肿瘤生长的作用,但未能有效抑制三阴性乳腺癌4T1荷瘤小鼠中的肿瘤生长。分析原因发现,Ano-3和Ano-3s可通过高效溶瘤作用诱导肿瘤ICD效应,但黑色素瘤肿瘤中CD8+ T细胞的浸润显著高于三阴性乳腺癌,提示肿瘤免疫抑制微环境(Tumor Immunosuppressive microenvironment, TIM)是溶瘤肽体内疗效发挥的潜在限制性因素。进一步实验中,采用中和抗体清除黑色素瘤荷瘤小鼠体内CD8+ T细胞后,Ano-3s抑瘤效果受到显著抑制,证明溶瘤肽抑瘤作用显著依赖CD8+ T细胞的浸润(图4)。以上结果揭示,Ano-3s可通过高效溶瘤作用激活机体抗肿瘤免疫,促进CD8+ T细胞浸润,有效抑制荷瘤小鼠体内黑色素瘤生长。
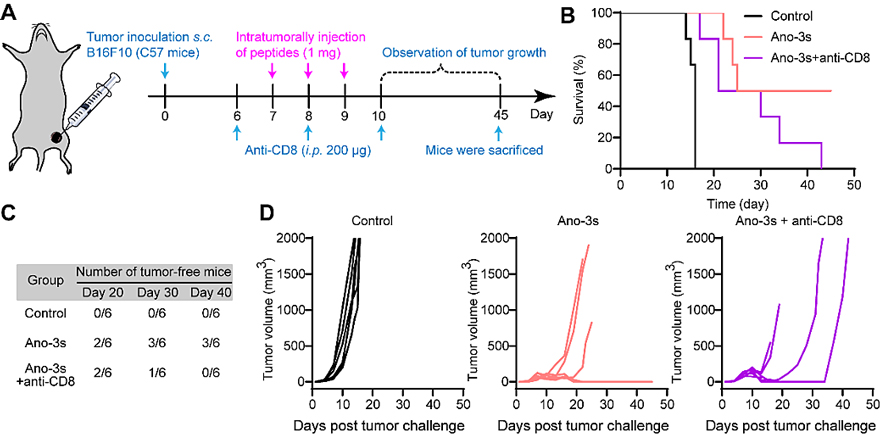
图4. Ano-3s诱导黑色素瘤B16F10荷瘤小鼠产生长期抗肿瘤免疫响应
本研究为构象锁定技术在天然来源多肽药物开发中的应用提供重要前期数据和创新思路,并为溶瘤肽免疫协同治疗在黑色素肿瘤中的创新应用提供重要依据。这一成果近期发表在Journal of Medicinal Chemistry 上,并受邀作为封面。文章的共同第一作者是上海中医药大学交叉科学研究院2018级博士研究生吴也和博士后陆冬,交叉科学研究院张卫东教授及陈红专教授团队栾鑫研究员为本论文共同通讯作者。本课题是在国家自然科学基金委(81903654)、上海市青年东方学者(QD2018035)、上海市晨光计划(18CG46)、上海市扬帆计划(19YF1449400)以及上海中医药大学“研究生创新培养专项”(Y2019064)等资助下完成。

原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Stapled Wasp Venom-Derived Oncolytic Peptides with Side Chains Induce Rapid Membrane Lysis and Prolonged Immune Responses in Melanoma
Ye Wu,⊥ Dong Lu,⊥ Yixin Jiang, Jinmei Jin, Sanhong Liu, Lili Chen, Hong Zhang, Yudong Zhou, Hongzhuan Chen, Dale G. Nagle, Xin Luan,* and Weidong Zhang*
J. Med. Chem., 2021, DOI: 10.1021/acs.jmedchem.0c02237
科研思路分析
Q:这项研究最初是什么目的?或者说想法是怎么产生的?
A:我们的研究兴趣是基于天然多肽开发新型抗肿瘤药物分子。溶瘤肽是一种结构明确、合成简便、安全性高,且免疫原性低的新型溶瘤药物,首个以“溶瘤肽”命名的药物分子LTX-315(Ruxotemitide, Oncopore®)目前正处于临床Ⅱ期试验阶段当中,可诱导多种肿瘤完全消融。目前已知的溶瘤肽主要来源于天然抗菌肽或受抗菌肽启发设计,然而天然多肽药物往往成药性较差,后续开发缓慢。基于课题组前期在多肽构象锁定方面的工作,创新性地将其应用于蜂毒溶瘤肽的改造,为天然多肽的创新转化研究提供思路,并为溶瘤治疗药物的开发提供潜在先导化合物。
Q:研究过程中遇到哪些挑战?
A:本项研究中最大的挑战是构象锁定蜂毒肽在体外对三阴性乳腺癌 4T1细胞和黑色素瘤B16F10细胞两种细胞株均有良好的溶瘤作用,但荷瘤小鼠体内仅对黑色素瘤生长产生良好的抑制作用,未能有效抑制三阴性乳腺癌的生长。为进一步揭示这一现象产生的机制,我们及时整合数据分析并调整研究思路,聚焦肿瘤免疫抑制微环境在溶瘤治疗中的潜在重要作用。进一步分析发现,肿瘤免疫抑制微环境(TIM)是溶瘤肽体内疗效发挥的潜在限制性因素,从而导致溶瘤肽在三阴性乳腺癌等免疫抑制微环境“冷肿瘤”上的较差疗效。
Q:该研究成果可能有哪些重要的应用?哪些领域的企业或研究机构可能从该成果中获得帮助?
A:该研究成果利用多肽构象锁定技术实现对天然多肽分子的结构修饰,显著增强其抗肿瘤作用,为后续溶瘤肽及中药及天然来源多肽分子的开发提供了重要前期数据和示范性研究,也为发展新型溶瘤治疗药物分子提供了重要依据。溶瘤肽作为一种新型肿瘤免疫治疗技术,可高效激活机体抗肿瘤免疫,最大程度发挥肿瘤免疫治疗的价值,提升肿瘤患者对于肿瘤免疫治疗的响应,将对肿瘤免疫疗法领域的发展产生推动作用。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号