Nat. Commun.:纪如荣团队发现巨噬细胞GPR37对抗败血症并揭示青蒿类药物抗疟疾的作用机制
Specialized pro-resolving mediators (SPM) 是一类由多聚不饱和脂肪酸 (如鱼油成分DHA和EPA) 代谢产生的具有生物活性的小分子。根据分子结构可分为Resovlins、Protectin/Neuroprotectin、Maresins等亚类。近年的研究表明SPM分子可通过结合细胞膜上一些特异的G偶联蛋白受体发挥抗炎和促进康复 (pro-resolution) 功能,在治疗疼痛,细菌和病毒感染等方面都有极高的临床应用价值。2018年纪如荣团队曾在Journal of Clinical Investigation 中报导GPR37是Neuroprotecin D1(NPD1)的天然受体,并且表达于巨噬细胞膜表面。NPD1可通过 GPR37激活来提高巨噬细胞的吞噬功能。GPR37在巨噬细胞的抗炎和镇痛功能中也发挥了重要作用。
败血症是低收入和中等收入国家孕产妇和新生儿发病率和死亡率的主要原因。败血症是指各种致病菌侵入血液循环而引发的全身感染,临床表现为高热、疼痛等。若机体不能及时将这些致病菌清除,将导致病情加重甚至死亡。此前,已知机体可通过巨噬细胞的吞噬和抗炎等功能对抗败血症,然而巨噬细胞GPR37在该过程中所发挥的作用尚不清楚。
近日,Nature Communications 刊发了美国杜克大学纪如荣团队(Sangsu Bang, Christopher Donnelly, 罗昕,Maria Toro-Moreno为共同第一作者)的最新研究成果,该团队发现巨噬细胞GPR37能在由不同致病菌引起的败血症动物模型中发挥保护作用,而Gpr37敲除则会加重实验动物的败血症症状和死亡率,并且抑制NPD1和青蒿琥酯(Artisunate)对败血症有治疗效果。

该团队的研究发现:(1)在分别由李斯特菌(L. monocytogenes)和伯氏疟原虫(Plasmodium berghei)引发败血症模型中,Gpr37敲除不仅加重了实验动物的症状和死亡率,也抑制了NPD1的治疗效果;(2)通过计算机三维模拟技术推测GPR37不仅是NPD1的受体,也可能是疟疾治疗药物青蒿琥酯(Artisunate,ARU)的受体;(3)青蒿琥酯能通过GPR37促进巨噬细胞的吞噬作用;(4)在分别由脂多糖(Lipopolysaccharides),李斯特菌和伯氏疟原虫引发败血症模型中,青蒿琥酯能通过GPR37对实验动物发挥保护作用;(5)在由李斯特菌引发的败血症模型中,消除体内巨噬细胞可加重实验动物的败血症症状及死亡率。(6)在由李斯特菌引发的败血症模型中,通过在Gpr37敲除动物中过继转移(adoptive transfer)NPD1和ARU刺激过的正常巨噬细胞可改善症状,而过继转移Gpr37缺乏的巨噬细胞则无法起到该效果。(7)局部注射李斯特菌可在实验动物中引发持续疼痛;Gpr37敲除则加重疼痛程度并延缓恢复;而青蒿琥酯可以通过激活GPR37产生镇痛作用。
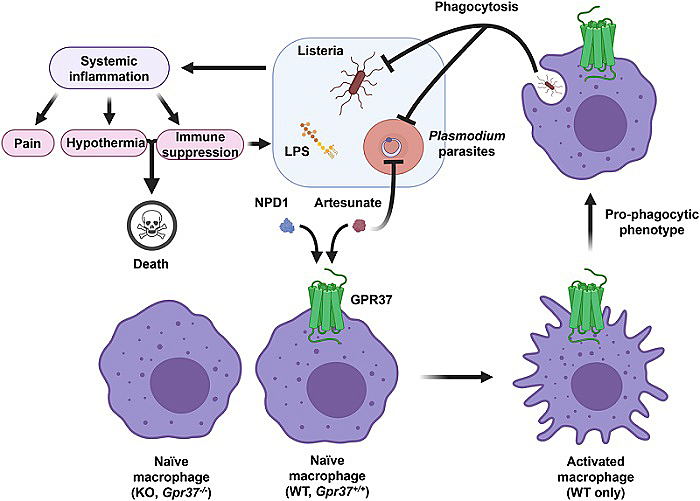
图1. NPD1以及抗疟疾药物青蒿琥酯可通过GPR37激活巨噬细胞。激活的巨噬细胞通过吞噬功能清除体内的李斯特菌以及感染疟原虫的红细胞以达到治疗败血症的效果。
因此,激活巨噬细胞上的GPR37在多种炎症相关疾病中发挥着保护作用;其中包括细菌感染、败血症、疟疾和疼痛。最后值得一提的是疟疾在东南亚和非洲依然引起很高的死亡率,而青蒿素一类药物的作用机制还不是很清楚。本文提示GPR37和巨噬细胞介导的免疫治疗可能是某些抗疟疾药物如青蒿琥酯的作用机制之一。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Activation of GPR37 in macrophages confers protection against infection-induced sepsis and pain-like behaviour in mice
Sangsu Bang, Christopher R. Donnelly, Xin Luo, Maria Toro-Moreno, Xueshu Tao, Zilong Wang, Sharat Chandra, Andrey V. Bortsov, Emily R. Derbyshire, Ru-Rong Ji
Nat. Commun., 2021, 12, 1704, DOI: 10.1038/s41467-021-21940-8
参考文献:
1. Bang S, Xie YK, Zhang ZJ, Wang Z, Xu ZZ, Ji RR. GPR37 regulates macrophage phagocytosis and resolution of inflammatory pain. J. Clin. Invest., 2018, 128, 3568-3582.
2. Xu ZZ, Zhang L, Liu T, Park JY, Berta T, Yang R, Serhan CN, Ji RR. Resolvins RvE1 and RvD1 attenuate inflammatory pain via central and peripheral actions. Nat. Med., 2010, 16, 592-7
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号