ACS Catal:L-苏氨酸醛缩酶不对称催化合成β-羟基-α-氨基酸
β-羟基-α-氨基酸是一类重要的医药中间体,常作为手性砌块用于合成多种药物,例如氯霉素、甲砜霉素、氟苯尼考等抗生素以及帕金森特效药屈昔多巴等。β-羟基-α-氨基酸有两个手性中心四种构型,分别是L-syn、L-anti、D-syn 和D-anti。目前,该类化合物主要通过化学法合成,反应条件苛刻,污染大,且不具有选择性。利用L-苏氨酸醛缩酶催化甘氨酸和相应的醛不对称合成手性β-羟基-α-氨基酸绿色污染小,原子利用率高,使的该合成路线具有极大的吸引力(图1)。L-苏氨酸醛缩酶对β-羟基-α-氨基酸Cα原子选择性十分严格(ee>99%),但是对其Cβ原子选择性相对较低,即对映体选择性高,非对映体选择性较低,不能满足工业化需求。
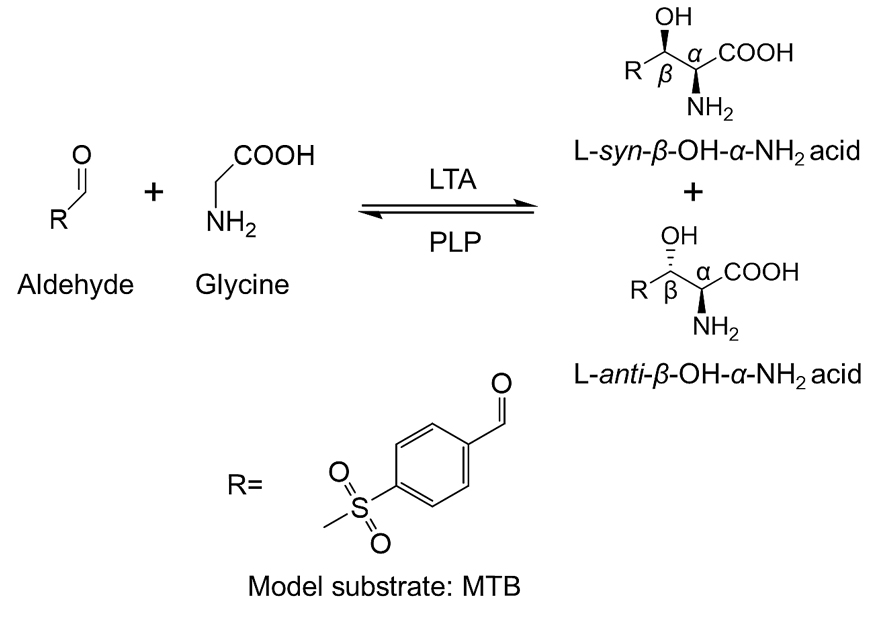
图1. L-苏氨酸醛缩酶(LTA)催化醛和甘氨酸生成β-羟基-α-氨基酸
近日,浙江大学吴坚平教授和徐刚副教授利用定向进化的方法改造L-苏氨酸醛缩酶,成功获得了非对映体选择性提高的突变体,该突变体被成功应用于L-syn-对甲砜基苯丝氨酸的合成。
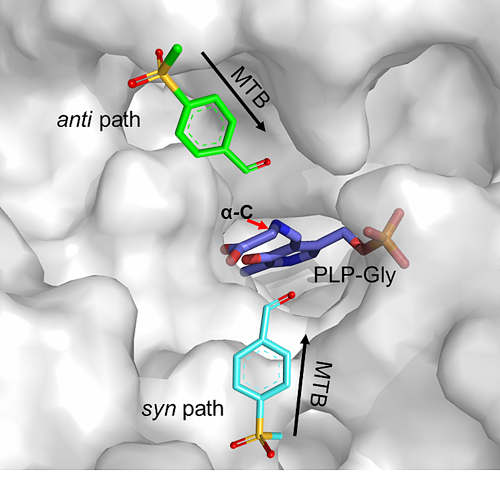
图2. L-苏氨酸醛缩酶非对应体选择性“路径假说”
L-苏氨酸醛缩酶为同源四聚体,每个活性中心由三个亚基的氨基酸残基组成,导致该酶的活性中心和底物结合口袋比较广阔,这是L-苏氨酸醛缩酶非对映体选择性低的重要原因。由于该酶非对映体选择性机理尚不清晰,改造难度较大,导致该瓶颈一直没有突破。针对以上问题,该课题组着眼于L-苏氨酸醛缩酶非对映体选择性机理研究。通过同源建模,分子对接和分子动力学模拟等技术首次提出了“路径假说”来阐述L-苏氨酸醛缩酶非对映体选择性机理。该假说认为“不同构型产物的形成是由于底物醛从不同的路径进入活性中心攻击PLP-Gly复合体所致”(图2)。以该假说为指导,将酶的活性口袋分为syn式路径区域(S区)和anti式路径区域(R区),选择活性口袋5Å范围内的27个氨基酸进行研究。借助计算机进行虚拟筛选,以及通过饱和突变实验验证,在每个区域中各选出了3个非对映体选择性影响显著的氨基酸位点。然后利用CAST/ISM策略对这些候选位点进行组合、迭代突变(图3)。最终得到了突变体RS1,其对L-syn-对甲砜基苯丝氨酸de值为97.3%(61.9%conv),在25%(v/v) DMF体系中de值甚至达到99.5%(73.2%conv)。值得注意的是在低转化率下,该突变体对2-NO2-、4-NO2-、4-CH3-和H-取代的苯丝氨酸衍生物的非对映体选择性也超过了99%。
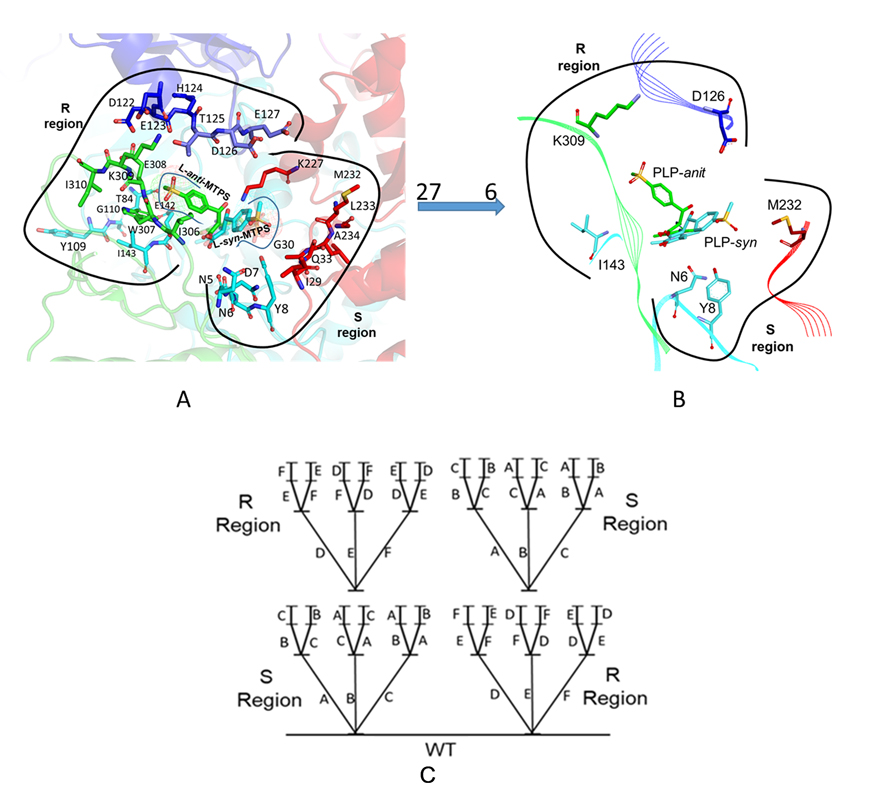
图3. CAST/ISM定向进化策略
综上,该工作提出了影响L-苏氨酸醛缩酶非对映体选择性的“路径假说”,并利用CAST/ISM定向进化策略,获得了非对映体选择性提高的突变体RS1,极大推进了L-苏氨酸醛缩酶在手性β-羟基-α-氨基酸生物合成中的应用。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Directed Evolution of l-Threonine Aldolase for the Diastereoselective Synthesis of β-Hydroxy-α-amino Acids
Wenlong Zheng, Haoran Yu, Sai Fang, Kaitong Chen, Zhe Wang, Xiuli Cheng, Gang Xu, Lirong Yang, Jianping Wu
ACS Catal., 2021, 11, 3198–3205, DOI: 10.1021/acscatal.0c04949
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号