基于CircLigase高效制备DNA单环和拓扑结构的新技术
注:文末有研究团队简介及本文科研思路分析
环状单链脱氧核糖核酸(circular ssDNA)在分子生物和DNA纳米技术等领域扮演着重要的角色,如作为滚环扩增的必备模板、DNA拓扑结构的构成单元等。目前常用的依赖于T4 DNA连接酶制备环状单链DNA的方法容易产生多聚体副产物,导致单体环产率低;而现有的基于CircLigase(一种单链环化酶)制备环状单链DNA的方法虽然可一定程度上减少副产物,但是随着底物DNA链长度的增大,CircLigase催化成环的效率急剧下降。因此,高效率地制备单链环形DNA仍是一个亟待解决的问题。

图1. 可被CircLigase催化高效成环的单链DNA模型示意图。图片来源: Anal. Chem.
近日,复旦大学顾宏周(点击查看介绍)团队报道了一种基于CircLigase高效制备DNA单环和拓扑结构的新技术。这一技术主要通过在单链DNA末端设计杂交的结构使得CircLigase参与的酶促反应由不可控的熵变主导转为可控的焓变主导,从而高效率(>75%产率)无副产物地合成DNA单环。该技术不仅将CircLigase的催化DNA成环产率稳定地提升至75%以上,而且突破了CircLigase对于可环化的DNA片段的长度的限制,在几百碱基的长链DNA上都得到了验证。课题组同时利用CircLigase预制备的单链DNA环作为起始组装材料获得了高纯度的DNA拓扑嵌套结构。
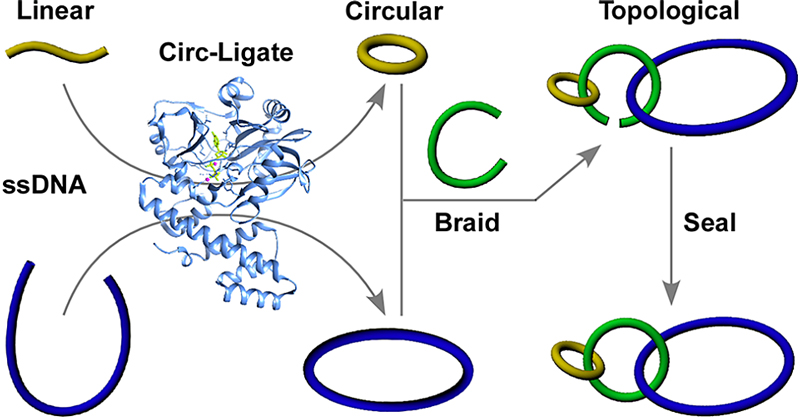
图2. DNA单环和拓扑结构制备示意图。图片来源: Anal. Chem.
此外,该团队进一步研究发现末端杂交结构可以从DNA分子内转移至DNA分子间,即末端杂交结构也可提高两条不同单链DNA分子间的连接效率。并且末端杂交结构可以由单链DNA底物自身互补配对提供,也可以通过一条辅助DNA链与单链DNA底物末端配对形成,两种杂交方式连接效率相当。随后,又提出末端结构通过拉近单链DNA底物5’和 3’端距离,从而提高CircLigase催化成环效率的猜想。
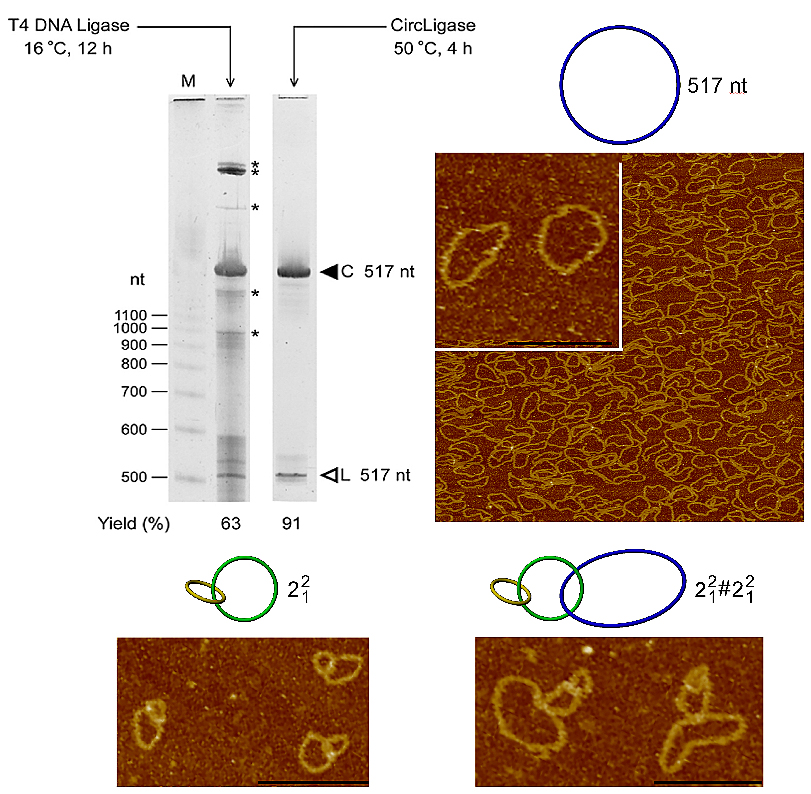
图3. T4 DNA ligase与CircLigase制备单链DNA环对比图及单环与嵌套结构表征图。图片来源: Anal. Chem.
这一成果近期发表在Analytical Chemistry 上,文章的第一作者是复旦大学博士研究生李青婷,通讯作者为复旦大学顾宏周研究员,该研究工作同时得到了上海交通大学樊春海院士的指导。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Programming CircLigase Catalysis for DNA Rings and Topologies
Qingting Li, Shu Zhang, Wei Li, Zhilei Ge, Chunhai Fan, Hongzhou Gu*
Anal. Chem., 2020, DOI: 10.1021/acs.analchem.0c04668
导师简介

顾宏周,复旦大学生物医学研究院研究员。2004年于中国科学技术大学取得学士学位,2009年于纽约大学取得博士学位,2009年至2015年在耶鲁大学工作,2015年6月起就职于复旦大学。
课题组致力于DNA纳米技术和核酸类分子探针的研究。目前一方面在探索DNA纳米结构设计的新方法,另一方面在组装筛选可检测重大疾病信号分子的核酸探针,希望通过这些研究为DNA纳米生物工程学与转化医学间搭起一座桥梁。
https://www.x-mol.com/university/faculty/184522
科研思路分析
Q:这项研究最初是什么目的?或者说想法是怎么产生的?
A:如上所述,课题组有两个研究方向,其中一个是组装筛选可检测重大疾病信号分子的核酸探针,在筛选过程中很偶然的发现末端互补配对的杂交结构对单链DNA库的成环有促进作用。于是我们首先确定了末端杂交结构对单链DNA高效成环的必要性,之后进一步系统地探究了末端结构各项参数:如反应温度、末端互补配对碱基数、末端不配对碱基个数和末端碱基种类等对成环效率的影响,并建立了可以被CircLigase催化高效成环的单链DNA模型。
Q:该研究成果可能有哪些重要的应用?
A:文章中提出了一种简单有效的在单链DNA末端设计杂交结构的策略提升CircLigase催化DNA成环的效率,而高产率和高纯度制备环状DNA不仅在纳米技术方面有潜在应用,也可用来筛选更加稳定的作为肿瘤诊断和治疗的新一代核酸适配体。值得一提的是,CircLigase本身在病毒中作为一种RNA连接酶。由于DNA与RNA化学结构相似,因此该研究中设计末端杂交结构提高CircLigase环化DNA效率的策略理论上也适用于RNA底物。利用这套策略原则上也可以稳定高效地合成天然存在的环状RNA分子,以便在体外研究其结构和功能。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号