蛋白质硫辛酰化修饰的化学标记
蛋白质硫辛酰化修饰(Protein Lipoylation)是一种从细菌到哺乳动物均保守的蛋白质翻译后修饰。在硫辛酰化修饰蛋白上,硫辛酸(Lipoic acid),一种含有五元环内二硫键的特殊脂肪酸,通过酰胺键连接在底物蛋白赖氨酸残基的侧链氨基上。迄今为止,哺乳动物中仅有5个已知的硫辛酰化修饰蛋白,它们都是细胞中重要代谢酶复合物的核心组分,硫辛酰化修饰在这些蛋白上是关键的催化中心。硫辛酰中的两个硫原子通过氧化还原循环在二硫键与巯基之间相互转换,完成酰基转移、电子传递等生化过程。虽然硫辛酰化修饰具有非常重要的生物学功能,但是目前领域内仍缺乏对其灵敏的标记、检测和蛋白质组学分析工具。
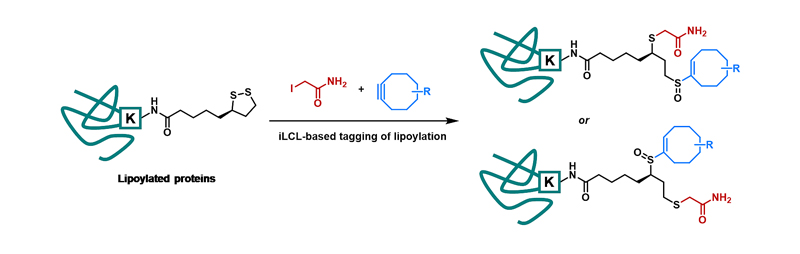
近日,北京大学化学与分子工程学院、北大合成与功能生物分子中心、北大-清华生命联合中心陈兴(点击查看介绍)课题组开发出一种新的化学方法能够对蛋白质硫辛酰化修饰进行化学特异性标记和组学分析。这种方法被命名为iLCL(Iodoacetamide-assisted lipoate-cyclooctyne ligation)。作者发现,硫辛酸中特殊的五元环状二硫键相比蛋白质内部半胱氨酸形成的线性二硫键具有更强的亲核能力,使得它能够与高浓度的碘乙酰胺(IAA)发生亲核取代-水解开环反应,生成不稳定的次磺酸(Sulfenic acid)中间体1。
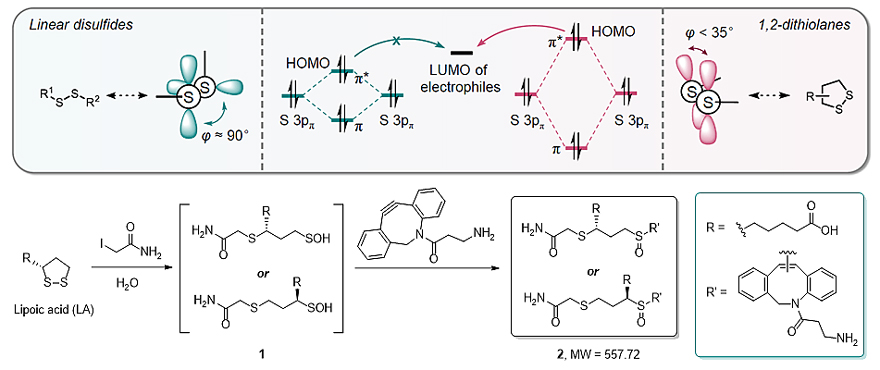
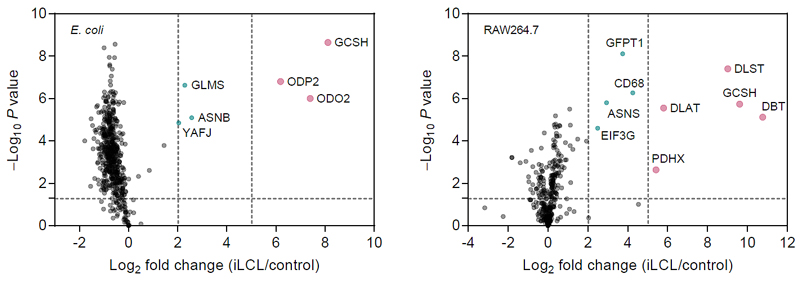
为了实现硫辛酰化修饰蛋白的灵敏捕捉,作者利用了环辛炔与次磺酸之间的Ene-type连接反应,使用二苯环辛炔(DBCO)衍生物对硫辛酸反应得到的次磺酸进行捕捉和标记,得到连接产物2。作者利用硫辛酸小分子与硫辛酰化修饰的单蛋白等模型系统对这一标记方法进行了验证与优化,并证明此方法能够高选择性高灵敏度地标记硫辛酰化修饰蛋白。随后,作者利用iLCL对大肠杆菌和小鼠巨噬细胞的裂解液进行了标记,并结合定量蛋白质组学技术,第一次实现了硫辛酰化修饰蛋白质组学的大规模鉴定,并成功在这两个体系种鉴定到所有已知的硫辛酰化修饰蛋白。有趣的是,作者发现天冬酰胺合成酶(Asparagine synthetase)与谷氨酰胺果糖-6-磷酸氨基转移酶(Glutamine-fructose-6-phosphate aminotransferase)在大肠杆菌和小鼠巨噬细胞中均有较高的富集度,暗示它们很可能是新的硫辛酰化修饰蛋白。
此工作近日发表在Angewandte Chemie International Edition,陈兴教授为本文的通讯作者,本文共同第一作者为北京大学化学与分子工程学院2018级博士生唐麒和郭怡兰,陈兴课题组已毕业的博士生孟丽莹也为本工作做出了重要贡献。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Chemical Tagging of Protein Lipoylation
Qi Tang, Yilan Guo, Liying Meng, Xing Chen
Angew. Chem. Int. Ed., 2020, DOI: 10.1002/anie.202010981
导师介绍
陈兴
https://www.x-mol.com/university/faculty/8611
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!











































 京公网安备 11010802027423号
京公网安备 11010802027423号