Nat Commun:α-型ADP-核糖化多肽的简单合成
注:文末有研究团队简介及本文科研思路分析
α-型ADP-核糖化多肽代表了蛋白质ADP-核糖化领域中一类重要的分子工具;但是,由于其固有的复杂结构和缺乏有效的合成工具,它们难以获得。近日,河南师范大学李凌君(点击查看介绍)团队与香港大学李祥(点击查看介绍)团队合作发展了一种仿生的α-选择性核糖化反应,可直接从天然β-烟酰胺腺嘌呤二核苷酸(NAD+)在清洁的离子液体系统中合成关键中间体α-ADP-核糖叠氮。然后,将该反应与点击化学反应串联,可两步模块化合成α-ADP-核糖化多肽。
ADP-核糖化是一种复杂的蛋白质翻译后修饰,它通过将一个或多个ADP-核糖(ADPr)单元从β-NAD+转移到蛋白质的特定氨基酸上,参与调控众多生理过程与疾病过程。在大多数情况下,ADP核糖化是一个高度动态且可逆的过程,可容易地以酶依赖性或自发方式从生成的ADP核糖化蛋白质中去除ADPr单元。尽管已鉴定出900多个ADP-核糖化修饰位点,但对ADP-核糖化过程机理的了解仍然落后。研究工具的不足极大地阻碍了该领域的生物学研究。因此,迫切需要人工合成在细胞环境中稳定并且可以模拟其生理功能的ADP-核糖化多肽。利用这些肽有望发展出ADP-核糖结合蛋白的新配体,得到富集及捕获内源性伴侣蛋白的新探针,以及制备出有效的抗原、推动位点特异性ADP-核糖化蛋白的抗体发现。
然而,由于其固有的结构复杂性,ADP-核糖化多肽的合成颇具挑战性。生物体通过SN1型酶促反应实现在游离烟酰胺核糖的1''位置形成一个α型糖苷键,但这很难通过化学合成方法来实现。化学全合成ADP-核糖化多肽需要从头合成α型核苷,然后逐步构建磷酸键和焦磷酸键。这些反应涉及到强酸催化、定位基选择及复制的保护和脱保护试剂,往往导致多步的合成路线、低收率和繁琐的实验操作。
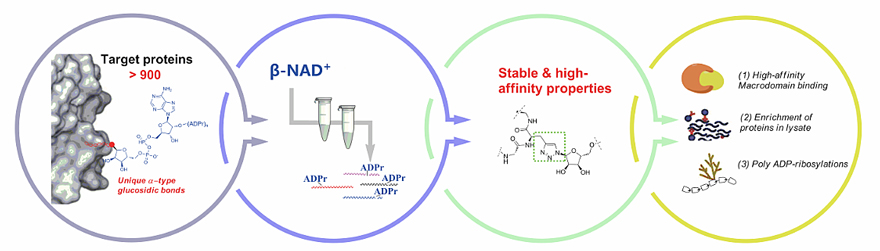
在该研究中,作者发现了一种仿生的α-选择性核糖化反应,可实现α-ADP-核糖化多肽的两步模块化合成。该路线使用干净的水性离子液体催化体系,可以在eppendorf(EP)管中进行,无需任何专业设备或培训。而且该方法能够实现规模化的仿生核糖基化制备(0.5 g规模)(仿生核糖基化收率为86%;目标肽的总产率> 82%)。更重要的是,通过这种方法制备的α-ADP-核糖基化肽在富集内源蛋白伴侣方面显示出高结合亲和力和稳定性,并在酶促的聚ADP-核糖化中显示出高效的反应性。总的来说,由于其简单的化学和多功能的生物学应用,该方法提供了目前最简便的ADP-核糖化肽的合成路线。
这一成果近期发表在Nature Communications 上,朱安莲博士、李欣博士和白莉莉硕士为论文的第一作者,李凌君教授、李祥教授为通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Biomimetic α-selective ribosylation enables two-step modular synthesis of biologically important ADP-ribosylated peptides
Anlian Zhu, Xin Li, Lili Bai, Gongming Zhu, Yuanyang Guo, Jianwei Lin, Yiwen Cui, Gaofei Tian, Lihe Zhang, Jianji Wang, Xiang David Li, Lingjun Li
Nat. Commun., 2020, 11, 5600, DOI: 10.1038/s41467-020-19409-1
作者简介

朱安莲博士,2007年毕业于中国科学院化学研究所获得博士学位,随后进入河南师范大学化学化工学院工作至今。主要从事功能溶液化学及离子液体在绿色催化反应中的应用研究。

李歆博士获香港研究资助局博士后基金支持,目前于香港大学化学系进行博士后研究。主要研究方向为表观遗传学相关蛋白化学探针的开发及功能探究。

王键吉,河南师范大学化学化工学院教授,博士生导师,主要从事离子液体结构-性质关系和绿色介质的研究。

李祥教授2011年加入香港大学化学系。课题组近年研究致力于开发新型化学工具和方法,以探究表观遗传学修饰的调控机制及生物学意义。
https://www.x-mol.com/university/faculty/67624

李凌君教授致力于核酸化学生物学研究,以人工设计合成核苷酸分子为工具,通过多学科交叉解决基因密码拓展、蛋白-蛋白相互作用等生物医学领域的问题。先后在Nat. Commun., J. Am. Chem. Soc., PNAS, Cell Chem. Biol等发表研究论文30余篇。设计合成的分子(如TPT3/NaM等)已被多领域科学家广泛使用;系列研究成果得到了Nature Research, Science Daily、ACS和新浪医药等媒体积极评述和采访报道。
https://www.x-mol.com/university/faculty/20145
科研思路分析
Q:这项研究最初是什么目的?或者说想法是怎么产生的?
A:如上所述,我们的研究兴趣是开发能够用于探索内源性核苷酸的生理和病理功能的化学生物学工具。众所周知,ADP-核糖化是一种复杂的蛋白质翻译后修饰,它参与调控诸如核酸损伤修复、神经退行等众多生理过程与疾病过程。在大多数情况下,ADP核糖基化是一个高度动态且可逆的过程,尽管已鉴定出900多个ADP-核糖化修饰位点,但对ADP-核糖化过程机理的了解仍然落后。研究工具的不足极大地阻碍了该领域的生物学研究。因此,迫切需要人工合成在细胞环境中稳定并且可以模拟其生理功能的ADP-核糖化肽。
Q:研究过程中遇到哪些挑战?
A:本项研究中最大的挑战是如何找到能够精准合成ADP-核糖化肽的方法。在这个过程中,我们团队在离子液体催化反应方面的经验积累起到了至关重要的作用。我们通过对结构多样的离子液体水溶液催化性能进行筛选,获得了清洁、廉价且操作简便的乳酸/二乙醇胺离子液体水溶液,利用它可以直接以商品化的NAD+为原料,一步、仿生制备α-型ADP-核糖叠氮。进而利用α-型ADP-核糖叠氮为中间体方便地模块化合成各种生物学用途的α-型ADP-核糖化肽。这项研究属于交叉学科的研究,其中需要合成化学、催化化学和生物化学的知识背景,来自河南师范大学的化学、催化团队与来自香港大学和北京大学的生物医学团队之间紧密合作推动了整个工作的顺利完成。
Q:该研究成果可能有哪些重要的应用?哪些领域的企业或研究机构可能从该成果中获得帮助?
A:ADP-核糖化是一种普遍存在于真核细胞和原核细胞的蛋白质翻译后修饰途径,它参与调控诸如核酸损伤修复、神经退行等众多生理过程与疾病过程。我们希望用这类制备方便、性能优良的α-型ADP-核糖化肽分子作为钥匙,开启下游一系列ADP-核糖化生理和病理功能的研究。具体可以从该成果获得帮助的研究领域包括结构生物、蛋白质组学以及从事新药物靶标确认的药理学研究机构。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号