Science:当乘风破浪的“Flow”遇上蛋白质合成
蛋白质是组成人体一切细胞、组织的重要成分,是生命的物质基础,而且,蛋白质和多肽类药物在制药领域也有举足轻重的作用。近年来,基于生物学方法或化学方法的蛋白质合成已经成为了学术界和工业界中非常重要的一部分。事实上,大多数蛋白质是通过生物学方法获得的,在生物系统中表达蛋白质具有产量高、速度快、污染少、可生产高分子量蛋白质等优势,但蛋白质产物的化学组成相对受限。如果要引入非天然氨基酸或进行精确翻译后修饰,化学合成的灵活性就高得多,然而化学合成蛋白质在目前仍然是一个十分复杂、耗时费力的过程。1963年,Merrifield发展了多肽固相合成法(SPPS),但是该方法合成速度慢且不适用于合成超过50个氨基酸的多肽。先前的研究表明,向反应器中加入固相载体并将其作为固定床运行,可以实现多肽的自动化和高保真合成(Tetrahedron Lett., 1970, 11, 4503–4505)。受此启发,美国麻省理工学院的Bradley L. Pentelute教授(点击查看介绍)课题组开发了一种自动化快速流动多肽合成(automated fast-flow peptide synthesis, AFPS)仪器(ChemBioChem, 2014, 15, 721–733; Nat. Chem. Biol., 2017, 13, 464–466),在90 °C下可快速合成包含30个氨基酸残基的多肽,平均每个氨基酸残基仅需短短40 s。合成速度上去了,但还要看到,人体中发现的大多数蛋白质长度都有约400个氨基酸,那么这种策略能否用于合成更长的肽和蛋白质呢?

Bradley L. Pentelute教授。图片来源:MIT
近日,Pentelute教授课题组在优化的AFPS方案下,在数个小时内以327个连续反应直接合成长达164个氨基酸的肽链。他们使用这种AFPS仪器,合成了九种不同的蛋白质,包括酶、结构单元和调节因子等。经过纯化和折叠后,合成蛋白质显示出与生物表达蛋白质相当的性质和活性。相关成果发表在Science 上。
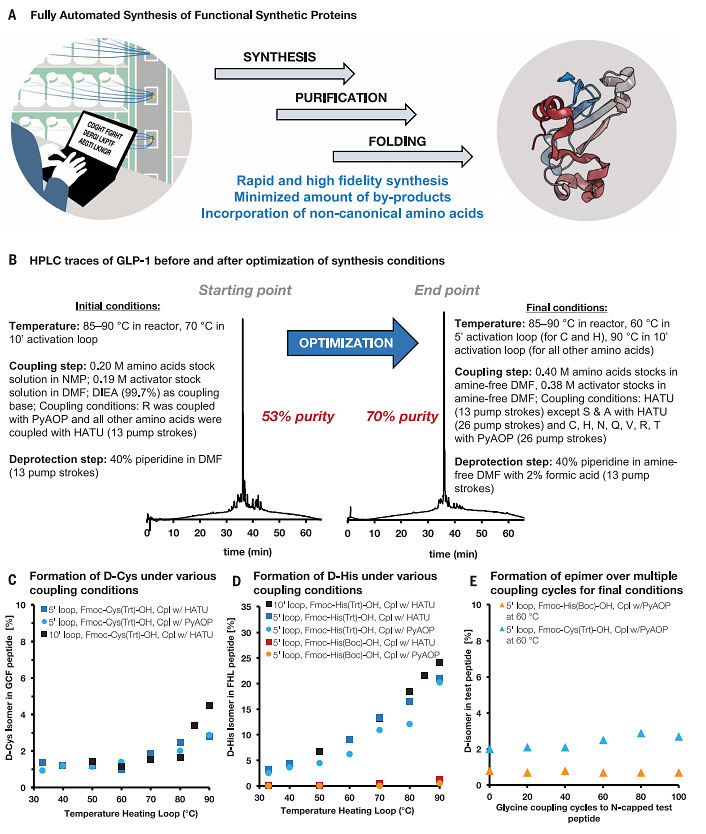
图1. 自动快速流动固相肽合成的条件优化可实现长氨基酸序列的高保真合成。图片来源:Science
关注X-MOL的读者,在看到“自动化”、“快速流动”这些词的时候,估计能迅速联想到在合成界“乘风破浪”的流动化学(Flow Chemistry)技术。这项技术,除了被科学家用于搭建自动化合成系统,也受到了工业界的青睐。辉瑞公司将其用于自动化高通量化学反应筛选,每天筛选超过1500个反应条件,还同时支持数百微摩尔量级的合成,满足后续生物活性测试的需求(Science, 2018, 359, 429, 点击阅读详细);礼来公司将其用于CGMP规范下的千克级药用化合物制备(Science, 2017, 356, 1144, 点击阅读详细)。所以,流动化学入选IUPAC评选的十项有潜能改变世界的化学创新(点击阅读详细),算得上实至名归。
回到这篇文章。首先作者对AFPS方案中的常规参数进行了优化(图1B),包括流速、反应溶剂、试剂浓度、温度和偶联试剂。同时还研究了不同活化剂在偶联步骤中的性能,从而确定了最佳活化剂——氮杂苯并三唑试剂PyAOP和HATU。鉴于天冬酰胺的形成是SPPS和AFPS中的主要副反应,因此作者筛选了各种脱保护基碱、添加剂、天冬氨酸保护基,结果显示较温和的脱保护基碱(哌嗪和HOBt与哌啶)和大位阻的天冬氨酸保护基(O-3-甲基戊基酯,OMpe)可以减少天冬酰胺的形成。然而,最有效的策略是加入甲酸作为哌啶的添加剂,并用二甲氧基苄基甘氨酸作为骨架保护剂。此外,作者在最终优化步骤中证实了具有高差向异构化风险的氨基酸(即半胱氨酸和组氨酸)的手性保持不变。如图1C、1D所示,这两种氨基酸的差向异构化随激活时间和温度而增加。事实证明,保护基的选择对组氨酸至关重要。在60 °C下于较短的时间内用PyAOP活化Fmoc-Cys(Trt)-OH和 Fmoc-His(Boc)-OH,得到< 2%的D-异构体。在这些优化条件下,差向异构体的数量不会在多个偶联循环中增加(图1E)。在手动覆盖N-端后执行100个氨基酸偶联后,D-异构体的数量没有变化,这表明半胱氨酸和组氨酸的差向异构化仅发生在激活步骤中。这使作者能够固定普适的AFPS方案,然后将其用于合成超过50个氨基酸的序列。
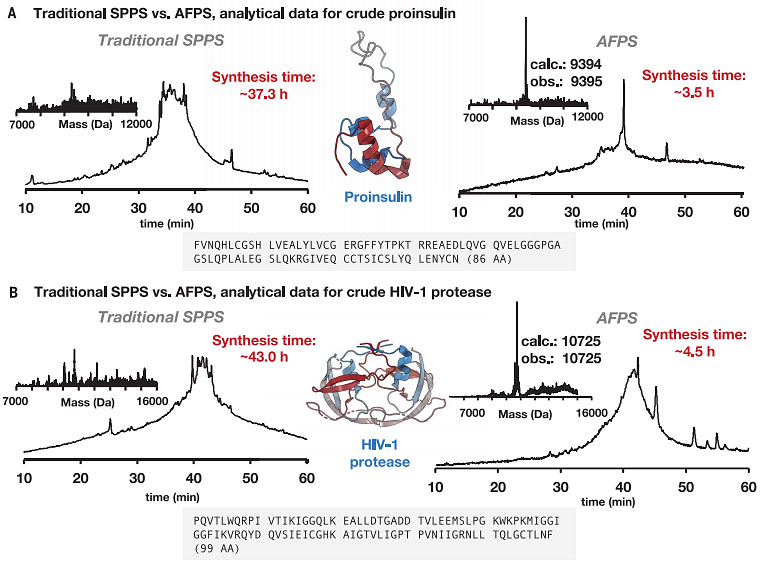
图2. 胰岛素原和HIV-1蛋白酶的合成证明了AFPS优于传统SPPS方法。图片来源:Science
接下来,作者尝试使用AFPS方案来合成胰岛素原(86个氨基酸)和人类免疫缺陷病毒1(HIV-1)蛋白酶(99个氨基酸),结果显示胰岛素原和HIV-1蛋白酶的合成分别在3.5 h和4.5 h内完成,纯化后可得到毫克级样品。此外,作者比较优化的AFPS方案与传统SPPS方法,结果表明优化的AFPS方案的产物纯度更高,所用时间更短(图2)。
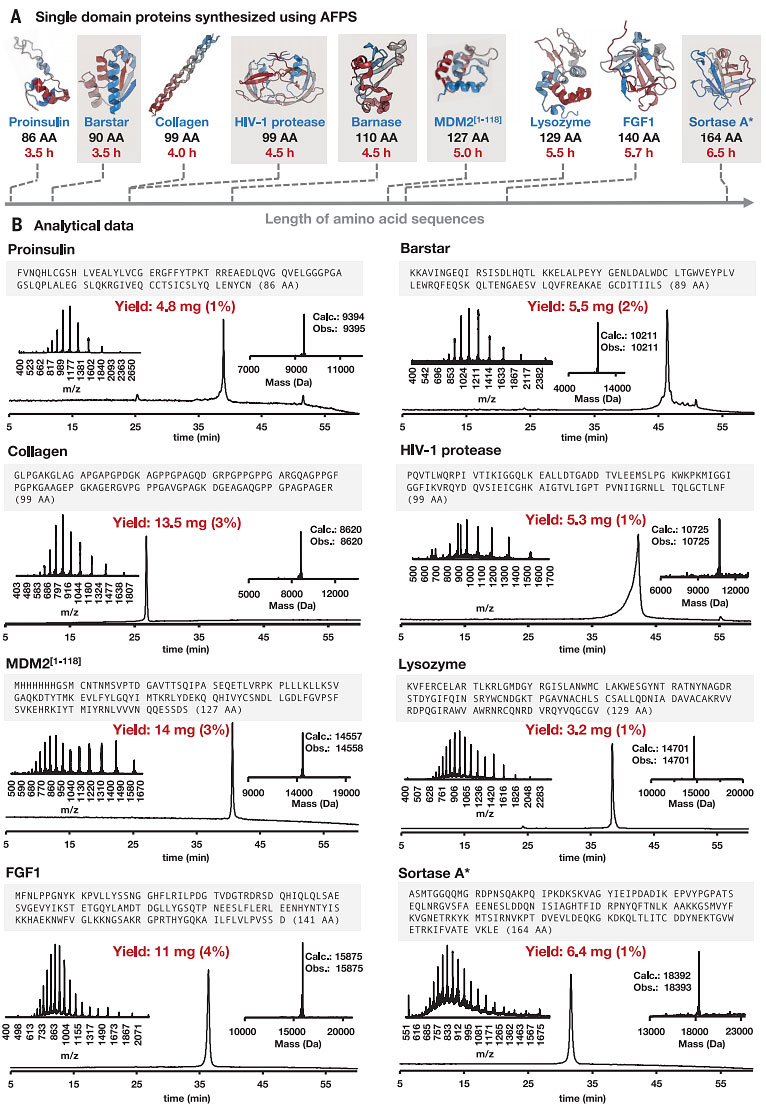
图3. AFPS可以在数小时内高保真地合成长氨基酸序列。图片来源:Science
为了证明AFPS方案的普适性,作者合成了长度~70至~170个氨基酸的多种蛋白链(图3A),其中包括药物研发相关靶标(如HIV-1蛋白酶和MDM2)和可作为治疗药物的蛋白质(如FGF1和胰岛素原)。通过合成含有定点突变的barnase和HIV-1蛋白酶的衍生物,证实了AFPS技术(与生物方法相比)能够快速、更大量、更多样化地引入非天然氨基酸。值得一提的是,所有肽链均在3.5 h至6.5 h内成功合成,并且每个合成过程中的主要产物均为所需的蛋白质,经HPLC纯化后得到毫克级产物,足够用于折叠或评估三级结构和生物学功能(图3B)。
化学合成的长链多肽或蛋白质,是否能正确折叠并具有生物学活性是关键问题。随后,作者通过分子排阻色谱法和离子交换色谱法对选定的合成蛋白进行了纯化和折叠,并通过生物物理和功能性质测定对其三级结构进行了表征。结果表明,基于AFPS方案的合成蛋白的三级结构与功能与生物表达的重组蛋白标准品相当(图4、图5)。这说明AFPS方法的保真度高,可合成共价结构明确和手性保留的合成蛋白。

图4. 合成的barnase和barstar折叠成天然三级结构,并显示出与重组样品相当的酶活性。图片来源:Science
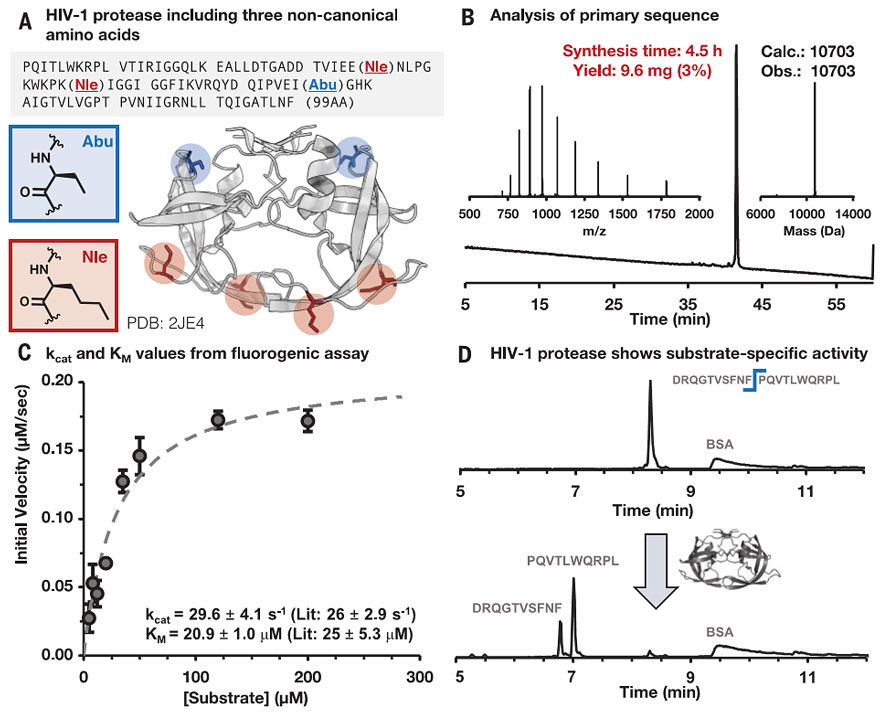
图5. 包含三个非天然氨基酸的合成HIV-1蛋白酶折叠成天然二聚体结构,并显示出与文献样品相当的酶活性和底物特异性。图片来源:Science
总结
Pentelute教授课题组优化了AFPS方案,实现了长链多肽和蛋白质的自动化快速流动合成,可快速制备与重组表达蛋白质具有相当三级结构及生物学活性的单结构域蛋白质,从而大大提高了化学方法在蛋白质合成中的应用潜能。这不仅有益于蛋白质研究,特别是那些难以通过生物学方法制备的蛋白质,还可用于快速按需生产个性化的多肽和蛋白质药物。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Synthesis of proteins by automated flow chemistry
N. Hartrampf, A. Saebi, M. Poskus, Z. P. Gates, A. J. Callahan, A. E. Cowfer, S. Hanna, S. Antilla, C. K. Schissel, A. J. Quartararo, X. Ye, A. J. Mijalis, M. D. Simon, A. Loas, S. Liu, C. Jessen, T. E. Nielsen, B. L. Pentelute
Science, 2020, 368, 980-987, DOI: 10.1126/science.abb2491
导师介绍
Bradley L. Pentelute
https://www.x-mol.com/university/faculty/621
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号