新型微流控单细胞芯片:细胞突起的高通量分离及其亚细胞基因表达研究
注:文末有研究团队简介及本文科研思路分析
癌细胞从原发肿瘤转移扩散到远处器官形成转移癌,导致了90%以上癌症病人的死亡。作为三种主要的癌细胞运动形式之一,间质型癌细胞通过伸出细胞突起来(cell protrusions)引导其迁移和侵袭。因此,深入分析和了解细胞突起中亚细胞基因表达将有助于进一步探索癌症转移的潜在分子机制,并可能探索出通过控制细胞迁移来预防肿瘤进展的独特疗法。然而,传统方法存在低通量、低分离精度、低纯度等问题,难以实现细胞突起中基因表达的精确分析。因此,发展高通量、高精度、高纯度分离细胞突起的分析方法将对癌症转移的研究起到极大的推动作用。
近日,美国康奈尔大学医学院附属休斯顿卫理公会研究所(Houston Methodist Research Institute)秦立东(点击查看介绍)团队开发了一个新型微流控平台(Protrusion-Generating Chip,PG芯片)。利用该芯片,成功制备了大面积高度均匀的细胞突起阵列。结合激光捕获显微切割(LCM)技术,可以单细胞精度高通量分离细胞突起,并成功获得了癌细胞突起的基因表达图谱。相关成果发表在《德国应用化学》(Angew. Chem. Int. Ed.)上,并被当期选为Frontispiece文章,文章的第一作者为康奈尔大学医学院附属休斯顿卫理公会研究所博士后张鹏超博士。
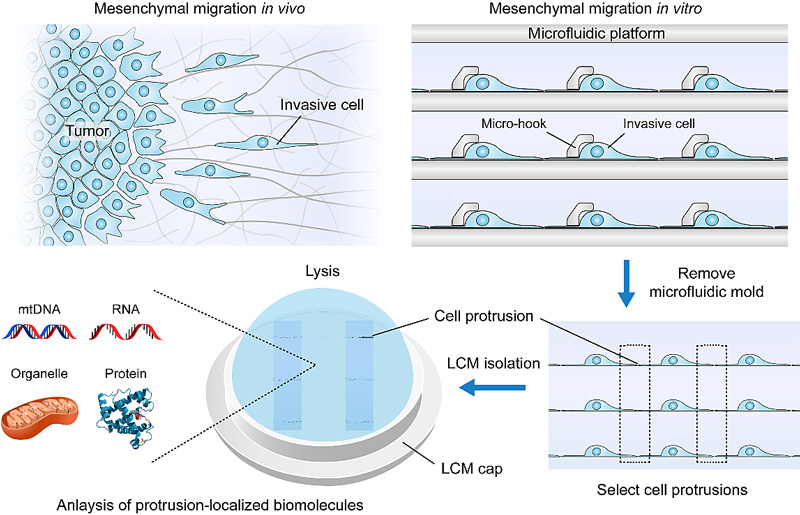
利用这一新型微流控单细胞芯片,通过形成大面积单细胞阵列(大于5000个单细胞)和原位培养,即可获得高度均匀的细胞突起阵列。除了间质性乳腺癌细胞,作者还实现了精确地排列多种细胞类型的突起(如黑色素瘤细胞、成纤维细胞、内皮细胞和神经元细胞)。这种均匀性水平不能用任何其他现有的方法来实现。
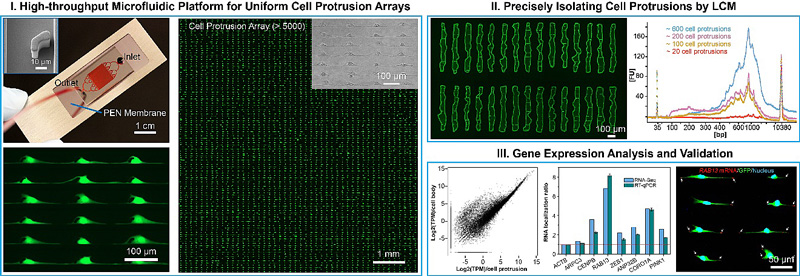
随后,利用LCM技术,作者首次实现了从这些细胞突起阵列中以单细胞精度成功地分离了高纯度的细胞突起。重要的是,细胞突起的数量可以根据需要随意控制,范围从一个到数千个均可快速实现。最后,作者从这些分离的细胞突起中成功地提取了信使核糖核酸(mRNA),并使用高通量测序技术获得了细胞突起的基因表达图谱。这一高度可控的细胞突起分离方法为癌细胞的迁移机制和相关信号通路的研究开辟了新途径。此外,新型微流控单细胞芯片将在伤口愈合、神经信号传导等多种细胞突起相关的生理过程中的信号通路的理解和研究方面具有良好潜力。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

High-Throughput Isolation of Cell Protrusions with Single-Cell Precision for Profiling Subcellular Gene Expression
Pengchao Zhang, Xin Han, Jun Yao, Ning Shao, Kai Zhang, Yufu Zhou, Youli Zu,Bin Wang, Lidong Qin
Angew. Chem. Int. Ed., 2019, DOI: 10.1002/anie.201903694
秦立东博士简介

秦立东,1999年毕业于吉林大学化学系,2007年获美国西北大学博士学位。2007年至2010年,在加州理工学院任博士后,从事转化医学相关研究。2010年开始,作为助理教授受聘于美国休斯敦卫理公会研究所,2013年晋升为副教授,2016年晋升为教授。秦立东博士致力于癌症转化医学研究,利用微流体技术,开发非常规技术平台,对癌细胞进行单细胞水平精确分析,以实现癌症早期诊断和转移机理研究。已经在Science, Nat. Nanotechnol. Nat. Commun. Sci. Adv., PNAS, Angew. Chem. Int. Ed., J. Am. Chem. Soc.等国际知名期刊上发表论文50余篇。研究成果曾被Science, Science News, ScienceDaily, The Scientist, Economic Times, Science & Technology Research News等专题报道。
https://www.x-mol.com/university/faculty/69084
科研思路分析
Q:这项研究最初是什么目的?或者说想法是怎么产生的?
A:如上所述,我们的研究兴趣是开发新型微流控器件并将其用于单细胞水平癌症转移相关研究。众所周知,癌细胞在迁移过程中会伸出细胞突起并在其引导下迁移,我们一直想仔细研究细胞突起中的基因表达水平。但是目前基于成像和细胞突起分离/测序的策略还存在很多问题,比如通量较低、分离的细胞突起纯度不高等,所以很难精确分析癌细胞突起中的基因表达水平。在前期的研究中,我们开发了一个微流控平台可以实现高效率单细胞阵列的构筑,原位培养后发现这些单细胞会像在体内迁移那样伸出细胞突起(PNAS, 2014, 111, 2948)。基于此,我们认为通过进一步优化有望实现单细胞精度细胞突起的高通量分离,所以才有了上述研究。
Q:研究过程中遇到哪些挑战?
A:本项研究中最大的挑战是如何获得大面积均匀分布的细胞突起并高通量地分离它们。在这个过程中,我们团队在微流控平台和生物表界面优化设计方面的经验积累起了至关重要的作用。
此外,这项研究属于交叉学科的研究,其中需要基因测序和分析方面的背景知识,而我们的团队主要来源于材料和生物医学工程专业,因此在分子生物学方面存在知识储备不足的挑战,未来希望有相关领域的研究者一起合作将研究推动到更高的层次。
Q:该研究成果可能有哪些重要的应用?哪些领域的企业或研究机构可能从该成果中获得帮助?
A:该平台可以实现大面积细胞突起的制备和分离,是研究细胞迁移分子机理的关键所在。对于深入分析癌症转移、伤口愈合等方面有着重要的应用前景。另外,该平台还可以用于药物筛选,将对相关领域的发展产生推动作用。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号