“白盒”机器学习法让抗生素更有效
对抗生素的研究是药学界经久不衰的课题。人类已经成功找到多种有效抗击细菌感染的抗生素药品,然而随着抗生素使用时间的增加,其用量会越来越大,药效却大不如前。这就是一直困扰我们的抗生素耐药问题。最近,来自麻省理工学院(MIT)的研究人员试图通过“白盒”机器学习,找到提高抗生素效力的新方法,解决抗生素耐药问题。
大多数抗生素都通过干扰细菌繁殖或生长的关键环节起作用,如干扰DNA复制或细胞壁构建。这种机制略显粗糙,细菌摄入抗生素后发生的一系列药物代谢变化一直以来都不为人知。
MIT医学工程与科学研究所(IMES)James Collins教授表示:“在抗生素压力下,细菌的能量需求变大。要想获得更多的能量,细菌必须增强其代谢反应,这过程中一些代谢副产物是有毒的,它们有助于杀死细菌。”Collins及其合作者想用机器学习的方法,找到这些能够杀死细菌的代谢因子。一旦发现这种因子,便可以与抗生素联用,开发出效力更高的药品。

James Collins教授。图片来源:MIT
“白盒”机器学习
Collins教授等人在研究抗生素作用机制领域积累了大量经验和成果。他们的研究表明,抗生素治疗往往会导致细菌的应激反应,使其产生巨大的能量需求。但代谢过程往往非常复杂,传统研究方法很难在这个多因素复杂过程中找到关键因子。研究者决定使用时下非常流行的机器学习方法去研究,到底哪些代谢产物在其中起到关键作用,以及会对细菌产生什么样的影响。
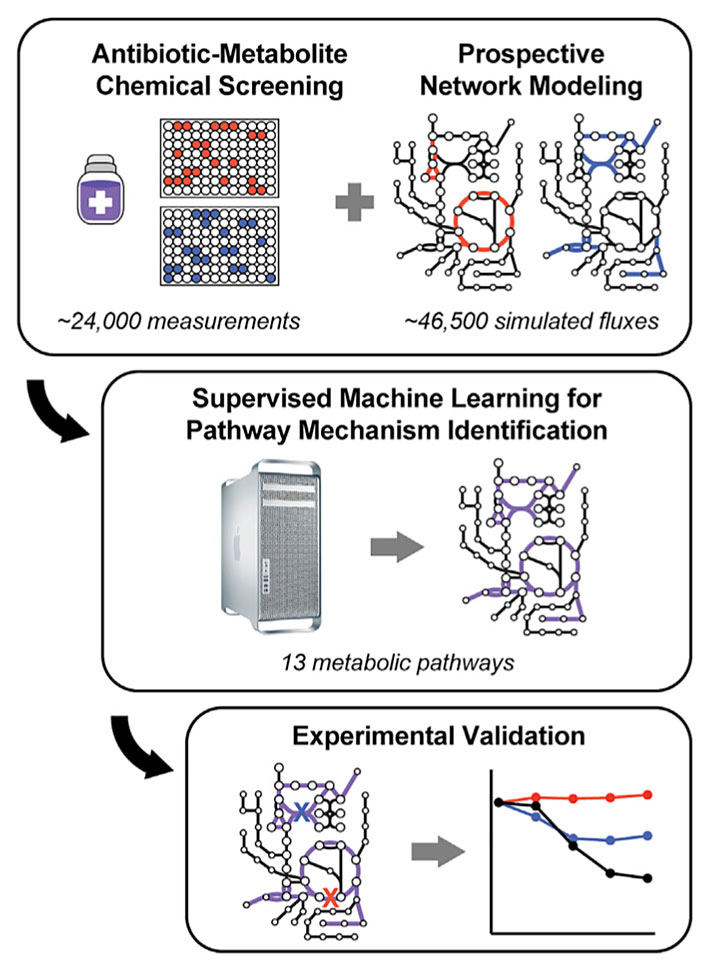
“白盒”机器学习研究细菌代谢途径方法。图片来源:Cell
在计算机建模之前,研究人员先在大肠杆菌中进行了数百次实验。他们选择了三种常用抗生素:氨苄青霉素、环丙沙星和庆大霉素,作为研究对象。每个实验中,他们向大肠杆菌培养基中添加一种抗生素,以及约200种不同代谢物中的一种,包括一系列氨基酸、碳水化合物和核苷酸。他们测试了大肠杆菌在每种抗生素和代谢物的组合中的存活率。
有了这些实验数据,下一步研究人员就可以建立机器学习模型了。这里尤其强调的是该研究中用的是并不多见的“白盒”机器学习法。与“白盒”相对的是“黑盒”,两者都是用机器学习模型来分析数据,通过训练算法基于数据生成结果预测。“黑盒”只有输入和输出,不会揭示构成其预测的机制,而“白盒”机器学习法则可以。
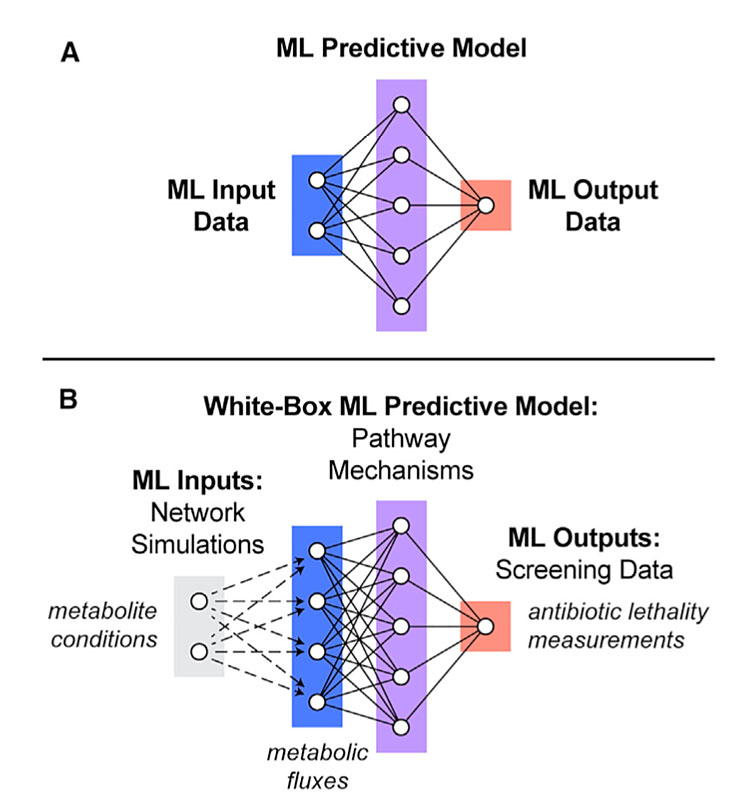
“黑盒”(A)与“白盒”(B)机器学习法的区别。图片来源:Cell
该研究团队不是直接将数据输入机器学习算法,而是先通过大肠杆菌代谢的基因组规模计算机模型进行运行,将产生的数据描述为“代谢状态”阵列。然后,他们将这些状态转换为机器学习算法,该算法能够识别不同状态之间的联系以及抗生素治疗结果。
斯坦福大学生物工程副教授Markus Covert评论这项研究是机器学习用于揭示生物输入-输出机制的重要一步。现代药学发展已经逐渐摆脱只(能)追求药效的时代,药效的机制研究在新药开发、老药新用、耐药性、毒理药理等多个领域的重要意义逐渐凸显。如果“白盒”机器学习法能应用于揭示药理机制,这无疑对药学发展有巨大助益。
嘌呤代谢加速细菌死亡
通过“白盒”机器学习模型,研究人员发现核苷酸代谢——尤其是嘌呤比如腺嘌呤的代谢——在抗生素杀死细菌过程中起着关键作用。抗生素治疗导致细菌应激,细菌努力增加核苷酸的产生,因为它们是复制DNA所必需的物质,这促进了细菌的整体代谢。而实际上,细菌增加嘌呤代谢是一种饮鸩止渴的方式。因为嘌呤代谢本身非常消耗能量,这使细菌本来已经入不敷出的能量供需更加失衡,陷入一种“恶性循环”。最终,细菌的嘌呤代谢会导致有害的代谢副产物积累,杀死自身。
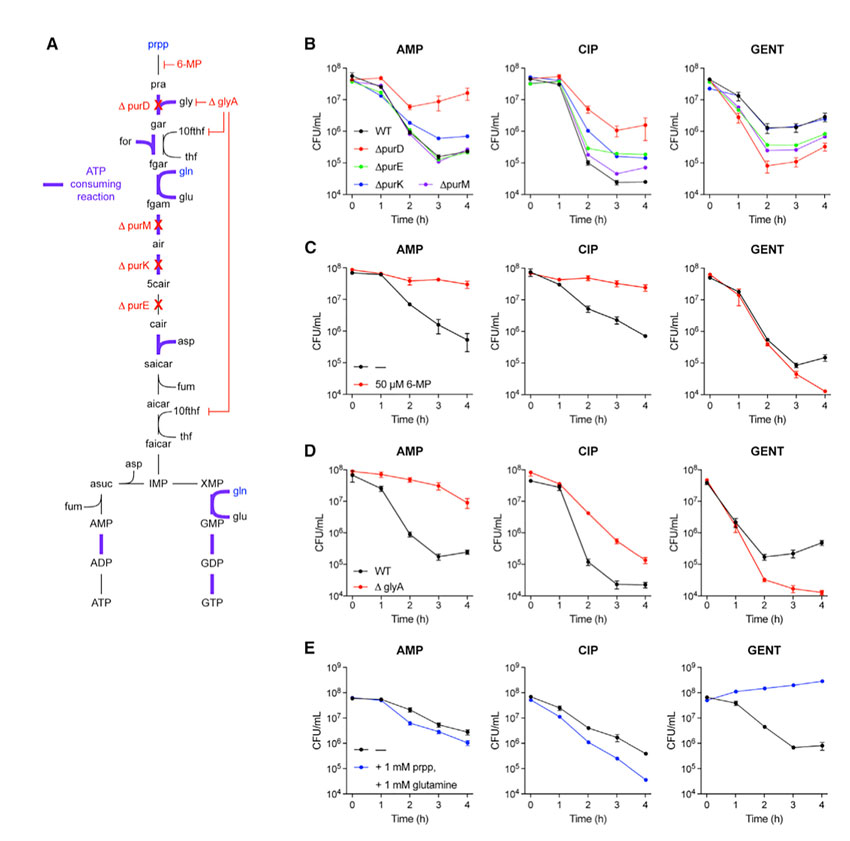
抗生素压力下细菌嘌呤生物合成途径。图片来源:Cell
研究结果表明,将某些抗生素与刺激代谢活动的药物联用,能够增强抗生素的杀菌作用。这或许是一种提高抗生素药效、抵御耐药性的潜在策略。
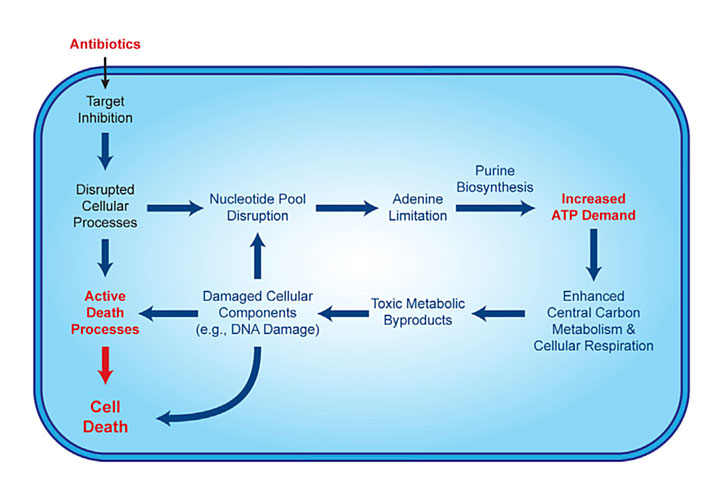
抗生素诱导的嘌呤受限,增加ATP需求并推动细菌碳中心代谢活动和耗氧。图片来源:Cell
此外,本研究中使用的“白盒”机器学习建模方法也可用于研究不同类型的药物如何影响癌症、糖尿病或神经退行性疾病等复杂疾病的机制。相信随着计算科学的发展,机器学习将更好地应用于生物医药领域,从而助力更多复杂疾病的新药发现。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A White-Box Machine Learning Approach for Revealing Antibiotic Mechanisms of Action
Jason H. Yang, Sarah N. Wright, Meagan Hamblin, Douglas McCloskey, Miguel A. Alcantar, Lars Schrübbers, Allison J. Lopatkin, Sangeeta Satish, Amir Nili, Bernhard O. Palsson, Graham C. Walker, James J. Collins
Cell, 2019, 177, 1649, DOI: 10.1016/j.cell.2019.04.016
参考资料:
1. Illuminating the dark side of machine learning
https://www.nature.com/articles/s41576-019-0140-4
2. Painting a fuller picture of how antibiotics act
http://news.mit.edu/2019/how-antibiotics-kill-bacteria-0509
(本文由氘氘斋供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!













































 京公网安备 11010802027423号
京公网安备 11010802027423号