Acc. Chem. Res.:张健组发展变构药物设计方法识别肿瘤新靶标并发现发现First-in-class先导化合物
新药创制是生物医药创新发展的核心驱动力。肿瘤作为全球最大的疾病领域,至今90%以上的恶性肿瘤依然缺乏高效、特异性强的药物,肿瘤创新药物研发面临从“细胞毒化疗”步入“精准靶向”阶段的战略刚性需求,亟需突破新靶标和原创先导化合物严重缺乏的现状。近日,上海交通大学医学院的张健(点击查看介绍)等在美国化学会旗舰期刊Accounts of Chemical Research (IF = 20.955)上发表了题为“Allosteric Methods and Their Applications: Facilitating the Discovery of Allosteric Drugs and the Investigation of Allosteric Mechanisms”的文章,阐述了该团队发展变构药物设计方法实现肿瘤新靶标识别和First-in-class药物先导化合物发现的工作。
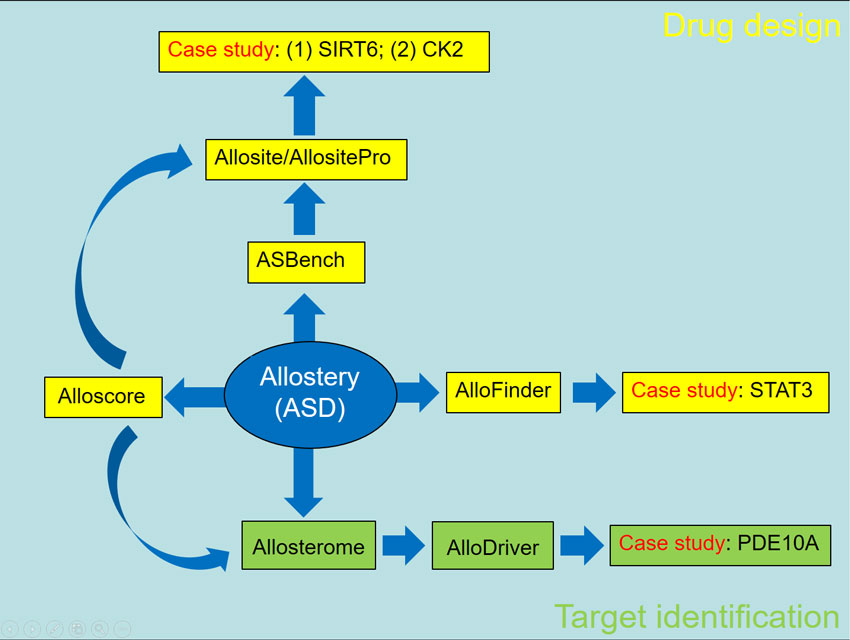
当前已确证的肿瘤中只有~25%识别了可供药物发现的靶标,且已识别的靶标中超过60%未发现先导化合物。当前根据肿瘤机制筛选候选靶标的策略,不利于针对机制未知的大多数肿瘤进行靶标发现;更为严峻的是,大量新靶标面临所需药效的作用位点未知(如酶激动剂)或位点缺陷(如蛋白-蛋白相互作用界面抑制剂)的问题,无法启动创新药物研发。生物大分子上天然存在着一类不易发现的变构位点(Allosteric site, 是指底物位点以外调控蛋白功能的位点,也称别构位点),这些位点具有高度多样性,被结合后可诱导构象变化实现对蛋白功能进行上调或下调。利用这一特征,张健带领其课题组发展了以构象诱导为基础的变构药物设计系列方法,解决了肿瘤患者敏感新靶标识别和新靶标原创先导化合物发现的瓶颈问题,具体如下:
(1)通过结合7000例临床基因组和变构数据分析,发现肿瘤基因组中影响基因功能的变化会规律性地富集于对应蛋白结构上的变构位点,并基于这个特征创新性地设计了精准靶标识别方法Allodriver:根据肿瘤样本基因组映射到蛋白变构位点的有害变化发生率来直接识别调控这类肿瘤的敏感蛋白靶标。利用该方法,从临床样本直接发现并验证了PDE10A是非小细胞肺癌特有的新靶标,并证明PDE10A抑制剂Dipyridamole可以有效杀伤非小细胞肺癌细胞,为我国当前肿瘤死亡率最高之一的非小细胞肺癌治疗提供了全新领域的靶标和药物先导化合物;
(2) 自2009年起领导课题组原创性地提出了“Allosterome”体系,经过10年积累建立了已知种属的变构生物大分子、变构位点、变构化合物和变构功能机制等实验数据交叉关联的数据库Allosteric database(ASD),并从ASD中提炼并创建了用于发展和评价变构位点识别方法所需的标准体系Asbench,为变构位点识别方法的建立和评价提供了高质量的数据基础和有益的方法指导;基于Asbench体系,申请人通过阐明变构位点空间和残基变化概率的分布,设计了普遍适用于蛋白质靶标的变构位点识别方法Allosite,利用该方法发现并验证了MCA2、NMDA1等多个靶标的全新变构位点;此外,挖掘发现了变构化合物分子的特征结构和性质,设计了从多个常用筛选库中富集符合变构特征化合物分子的集中库方法Allolike,提高筛选库中变构候选分子数量;另一方面通过识别变构化合物分子在位点上引发“构象诱导”的机制,创新性地提出针对变构位点化合物活性的精准评价方法Alloscore,将变构复合物活性的预测精度显著提高。在整合Allolike和Alloscore方法的基础上, 2018年采用在变构位点进行多构象采样的策略,建立了变构位点化合物筛选方法Allofinder,将变构位点筛选化合物的成功率提高了数倍。张健等发展的变构药物设计方法10年来在国际上获得广泛使用,并与多家药物研发机构签约合作开发First-in-class药物先导。
(3)新靶标中有一大类亟需激动的蛋白,与抑制剂设计直接寻找底物的竞争分子不同,这些靶标的激动型药物研发一直是难以进行的重大问题。利用自主发展的变构药物设计系列方法,张健等解决了肝癌新靶标SIRT6去乙酰化激动效应位点缺失的问题并发现SIRT6首个功能激动剂MDL-800,在转移瘤动物模型上显著抑制肝癌生长。除此之外,还在STAT3,CK2,CDK2等多个肿瘤重要靶标上发现了多类变构活性分子。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Allosteric methods and their applications: facilitating the discovery of allosteric drugs and the investigation of allosteric mechanisms
Shaoyong Lu, Qiancheng Shen, Jian Zhang
Acc. Chem. Res., 2019, 52, 492-500, DOI: 10.1021/acs.accounts.8b00570
研究团队简介
张健,上海交通大学医学院特聘教授,医药生物信息学中心主任,国家自然科学基金委优秀青年基金、中组部万人计划青年拔尖人才及教育部青年长江学者获得者,国家自然科学基金委创新研究群体成员。2002年毕业于北京大学药学院,获药学学位,北京大学优秀毕业生,免推至中国科学院上海药物研究所, 2007年获药学博士学位,全国优秀博士论文。2009年回国受聘于上海交通大学医学院至今。张健教授主要发展变构药物设计方法,并利用上述方法在精准靶标识别和First-in-class原创药物先导发现等方向做出了一系列突破性成果。以通讯作者在包括Nat Chem Biol, Chem Rev, Chem Soc Rev, Am J Hum Genet, Nucleic Acids Res, J Med Chem 等国际学术杂志上发表SCI论文70余篇。近5年代表性工作包括:(1)发现肝癌靶标SIRT6首个功能激动剂MDL-800 (Nat Chem Biol, 2018);(2) 发现结肠癌恶性转移靶标APC-Asef相互作用首个抑制剂MAIT-203 (Nat Chem Biol, 2017);(3) 发展临床样本来源的全新靶标识别方法AlloDriver (Am J Hum Genet, 2017);(4) 发展变构药物设计方法发现多种全新变构活性小分子 (Nucleic Acids Res, 2019,2018, 2016, 2014, 2011; Bioinformatics, 2016, 2015, 2013)。他引超过3500次,H因子为38,获国内外专利9项(第一发明人5项)。受邀以通讯作者在国际顶尖综述杂志Chem Rev (IF=52.613)、Chem Soc Rev (IF=40.182)撰写变构药物机制综述,均作为封面文章重点推荐;受Springer-Nature出版社邀请作为主编撰写国际首本变构药物发现类书Protein Allostery in Drug Discovery;担任Nat Chem、Mol Cell、Nat Commun 等40余种SCI期刊审稿人,澳大利亚Austrian Science Fund (FWF)等基金和西班牙University of Barcelona等学校Tenure考核的国际评审人。由于在“精准靶标识别和First-in-class药物先导发现”方面的贡献,获得美国化学会Excellent Research Advisor、中国药学会生物医药创新奖、2017年中国十大科技新锐人物、Roche Creative Chemistry Award和药明康德生命化学研究奖等荣誉。
https://www.x-mol.com/university/faculty/49695
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号