Science:有机合成中的“断舍离”
副标题:氢化脱烯实现C(sp3)-C(sp2)键断裂
在合成一个新的分子时,人们的惯性思维一般是采取直线式或者是汇聚式的合成方法,利用一些简单的合成砌块通过类似堆积木的方式得到目标产物;很少会反过来,对复杂结构分子进行“解构”,切断分子中特定位置的化学键,得到结构相对简单的目标产物。在有机合成化学领域,手性中心的构筑是困扰合成工作者最大的问题之一,尽管多数时候人们能够通过常规的方法来实现这一目标,但如果能够利用已经含有目标手性中心的分子作为底物,通过选择性的C-C键断裂也可获得目标分子。不过,后者这种“解构”策略有个前提,那就是这种作为底物的手性分子廉价易得,或者已实现大规模商品化,或者可从天然产物中方便大量地分离,否则就没有任何实用意义(可比照最近某厂商的“水氢车”闹剧)。此外,利用这种“解构”策略甚至在某些时候能得到一些常规方法难以得到的分子。目前文献中报道的化合物C-C键断裂常用的方法中,C(sp2)-C(sp2)键断裂的方法相对较多,比如臭氧解、烯烃复分解等(图1A),但C(sp3)-C(sp3)键断裂的方法很少,通常需要通过相邻的杂原子、环张力作用或者是离去基团对C(sp3)-C(sp3)键进行活化(图1A)。相比之下,C(sp3)-C(sp2)键断裂的方法在文献中报道更少,例如对于甲苯的脱甲基化,反应需要高达500-600 ℃的温度以及在40-60 atm H2的条件下才能够实现氢化、消除甲基的目的。考虑到大量的有机分子中含有这类烯基基团,选择性断裂C(sp3)-C(sp2)键具有十分重要的意义。
最近,美国加州大学洛杉矶分校的Ohyun Kwon教授(点击查看介绍)课题组在Science上报道了通过氢化脱烯(hydrodealkenylation)的策略实现了以上过程(图1B),反应在O3、MeOH存在的条件下发生烯基臭氧解,随后在亚铁盐的还原作用下形成氧自由基物种,并发生α均裂形成碳自由基,进而攫取氢原子供体(HAD)PhSH的氢得到最终产物。其净结果是C(sp3)-C(sp2)键断裂,并伴随着C(sp3)-H键形成。反应可在空气中进行,并具有良好的收率,能兼容多种官能团。基于这种方法,他们用可从植物大量获得的廉价萜烯和萜类衍生前体生成了所需的合成中间体,其中有许多具有光学活性;此外还实现了多种复杂分子的全合成,大大缩短了反应步骤并且收率更佳(图1C)。
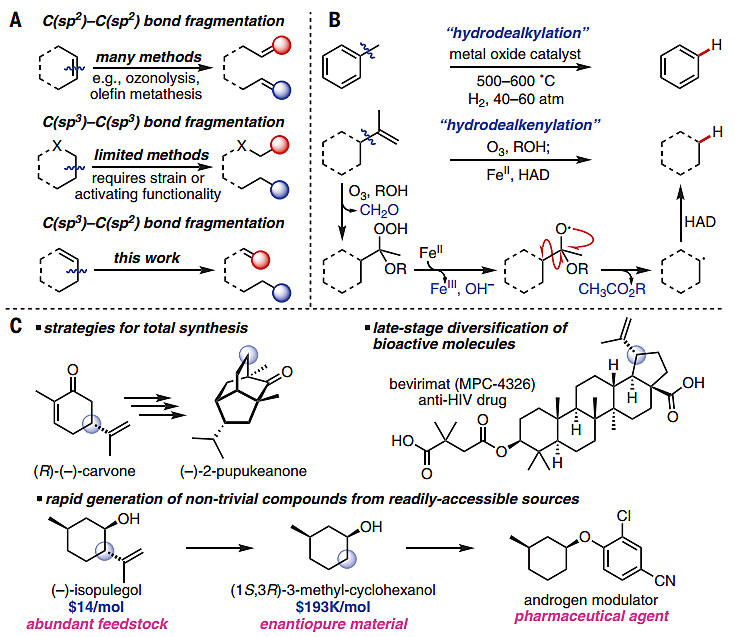
图1. 氢化脱烯实现C(sp3)-C(sp2)键的断裂。图片来源:Science
这项研究起源于作者之前发表的工作(ACS Catal., 2018, 8, 5188),他们在制备Carvone衍生的膦手性中心的催化剂时发现,亚铁盐结合HAD在Schreiber条件下可以实现C(sp3)-C(sp2)键断裂,随后形成新的C(sp3)-H键(图2)。他们通过大量含有异丙烯基的手性分子展现了该策略的普适性,并且将其应用到天然产物的全合成中,大大缩短了这些化合物合成的步骤,并提高了其收率。
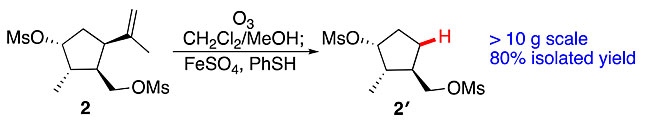
图2.C(sp3)-C(sp2)键断裂反应。图片来源:ACS Catal.
这项工作中,作者以羟基酮1a作为模板底物对反应条件进行优化,使用1.2当量的FeSO4•7H2O和1.5当量的PhSH便可以几乎定量的收率得到目标产物。随后他们对底物的适用范围进行考察,这些底物都是含有异丙烯基的手性分子。通过该方法得到的Wieland-Miescher酮2e和ent-2e是构建复杂分子的重要模块,文献中报道了超过50例全合成工作中使用该中间体;此外,天然萜类和复杂的三萜类化合物在标准条件下也能得到相应的目标产物。随后,作者以1h作为底物,将反应规模放大到100 mmol,能以良好的收率(89%)得到光学纯的2h,进一步展示了该方法的应用潜力。
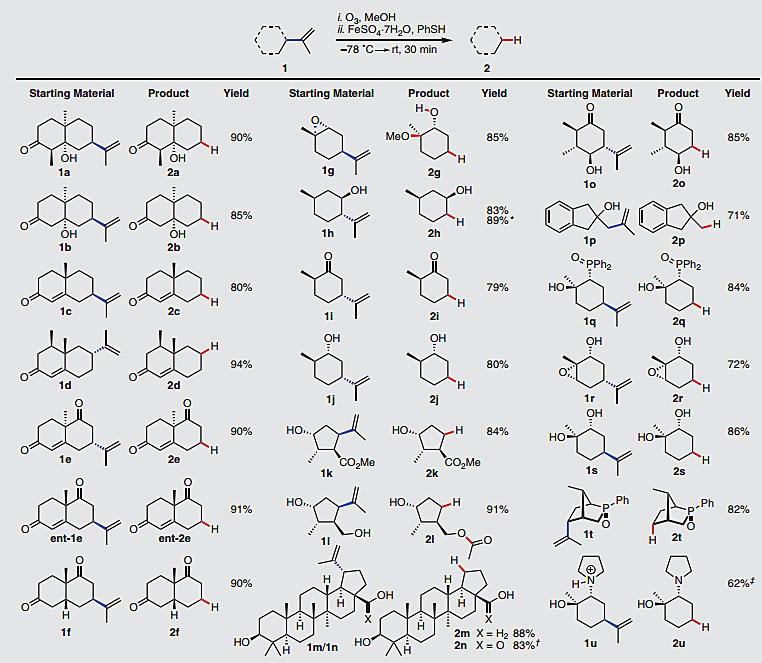
图3. 底物的适用范围。图片来源:Science
为了进一步扩大底物的适用范围,作者选取了一些含有其它类型双键修饰的化合物,如含有环外亚甲基和环内双键,由此得到酯及缩醛类产物。在这些例子中底物含有多个C(sp3)-C(sp2)键,大部分底物参与反应具有良好的选择性;含有环内双键的底物反应后加入乙二醇和对甲苯磺酸回流,结果得到脱烯开环的缩醛产物。这类分子通过其它的方法很难生成,尤其是具有较大张力的手性四元环产物。
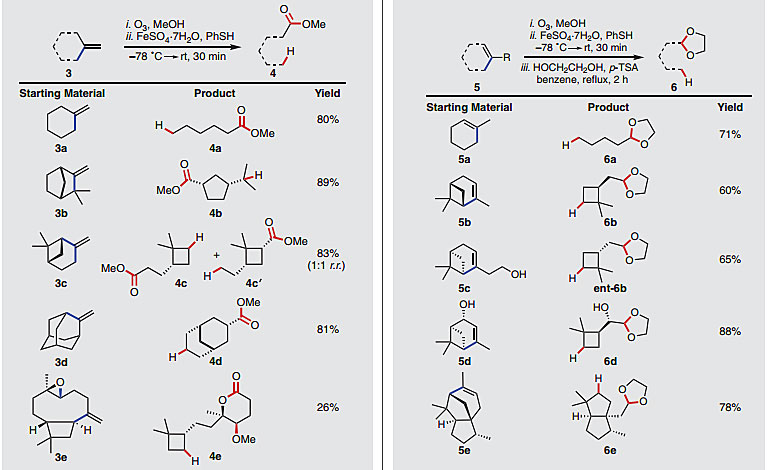
图4. 氢化脱烯策略合成酯和缩醛产物。图片来源:Science
为了考察该方法的实用性和官能团兼容性,作者选取了五种天然产物分子: (–)-2-pupukeanone、(–)-seychellene、(–)-7-epibakkenolide-A、periconianone A以及一种手性的甾体分子,比较了它们利用文献中报道的全合成方法和该氢化脱烯策略的收率和反应步骤。总体看来,氢化脱烯策略大大缩短了反应步骤,分别从3至6步反应缩短到1步,并且收率更佳。
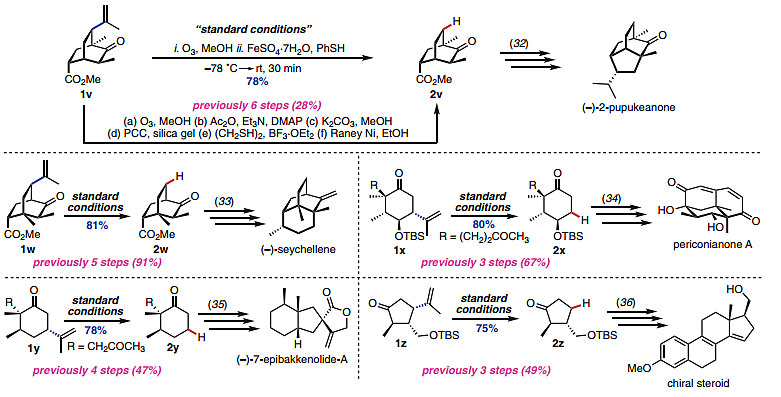
图5. 氢化脱烯策略在全合成中的应用。图片来源:Science
最后,作者通过环丙烷开环实验和TEMPO捕获自由基实验等证明了在脱烯过程中会有烷基自由基生成。这类含有烯基的化合物目前还很少用作烷基自由基的前体,未来有望在自由基化学中取得新的应用。
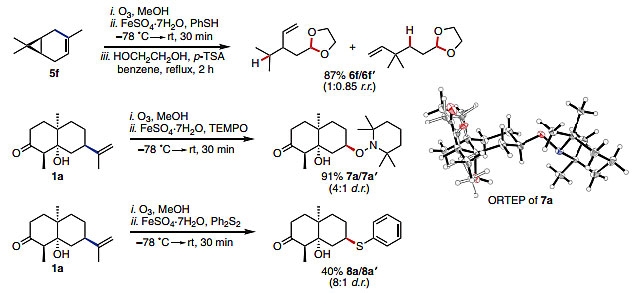
图6. 自由基形成的验证实验。图片来源:Science
全球生物科技巨头Amgen公司的Seb Caille在同一期的Science上撰文(Science, 2019, 364, 635),对这一研究成果给予了高度评价,人们通过这种方法能够从植物提取的分子经过简单的步骤得到复杂的手性分子,同时这一策略也缩短了分子的合成周期,降低反应的成本,在药物的工业生产的中具有潜在应用价值。
总结
Ohyun Kwon教授课题组通过O3、亚铁盐以及氢原子供体PhSH实现了一系列复杂含烯基分子(例如可从植物大量获得的廉价萜烯类分子)的C(sp3)-C(sp2)键的断裂,以高收率得到了光学纯的氢化脱烯产物。他们还通过数个天然产物分子全合成的例子证明了该方法的简便与高效。“断”一个键,“舍离”了多个合成步骤,这种非常规的解构过程在药物发现、逆合成分析、化合物后期修饰中将有重要的应用。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Hydrodealkenylative C(sp3)–C(sp2) bond fragmentation
Andrew J. Smaligo, Manisha Swain, Jason C. Quintana, Mikayla F. Tan, Danielle A. Kim, Ohyun Kwon
Science, 2019, 364, 681, DOI: 10.1126/science.aaw4212
导师介绍
Ohyun Kwon
https://www.x-mol.com/university/faculty/849
(本文由有所不为供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!













































 京公网安备 11010802027423号
京公网安备 11010802027423号