溯洄从之,道阻且长:通往生命起源的化学之路
生命是如何在地球上起源的?在生命起源中扮演着重要角色的原始细胞,又是如何在地球上诞生的?这些话题引人瞩目,有趣而复杂,又极具挑战性,深深吸引了本文的主角——诺贝尔奖得主、美国麻省总医院的Jack W. Szostak教授(点击查看介绍)(图1)。他和他的同伴们多年来一直致力于用化学思维和方法探索生命起源尤其是原始细胞的形成机制。这是一条回溯我们这个星球古老故事的探索之路,这条道路深远而曲折。如同Jack W. Szostak教授所言,17世纪末,著名诗人Basho进入江户时代的日本北部,开启神秘而又兴奋的旅行,一路旅途中,诗人记录时而艰辛曲折,难以为继,时而风景旖旎,激动人心。Jack W. Szostak课题组的科学之旅就是这样,有“所谓伊人,在水一方”的期待与追求,更有“溯洄从之,道阻且长”的体验和收获。

图1. Jack W. Szostak 教授。图片来源:nobelprize.org(左图)[1]/ cienciadelsur.com (右图)[2]
他们的探索旅途开始于原始细胞的研究。他们认为,地球上第一批活细胞起源于含有随机序列寡核苷酸的大量囊泡。假如这些囊泡能够生长和分裂,它们的遗传内含物能够复制,且在某些非常罕见的情况下,核苷酸序列能够形成催化剂或者一些对宿主有利的结构,那么达尔文进化论式的起源阶段就可以出现。于是,他们致力于实验条件下构建原始细胞模型,研究原始细胞的生长、分裂和细胞内遗传物质的复制,以及在这些过程中需要的原料、能量和化学环境。
由于第一批原始细胞没有进化出成熟的机制来控制其生长和分裂。只能把这些关键生物化学过程寄托于复杂多变的外在环境。那么,是怎样的有效环境能够驱使原始细胞膜生长,进而促进原始细胞的生长和分裂呢?他们想到,最简单的情况是存在一种能够间歇性掺入囊泡膜中的分子。这样就很容易考虑到脂肪酸分子(图2)。它们能够在pH-依赖的浓度差驱使下,从高pH值的小胶束中转移到中性,或者弱碱性环境下的脂双层膜中。于是他们进行实验,把含脂肪酸胶束的碳酸氢钠溶液添加到含预成型囊泡的缓冲溶液中,胶束相变得热动力学不稳定,一些脂肪酸分子插入到囊泡双分子层膜中,并促使膜的生长。更值得注意的是,这导致了长丝状囊泡的形成。这种囊泡在溶液中能够被温和剪切力或化学变化所诱导进而分裂(图3)。他们从实验条件下的观察结果出发,延伸到地质化学角度来推测,出现了这样的场景:在地球早期环境中,携带脂肪酸的碳酸氢钠水流间歇性注入生长着原始细胞,低pH值的池塘或水池,池塘或水池的简单蒸发导致自由态脂肪酸浓度增加,浓度增加又趋使它们形成双层膜,导致丝状囊泡生长,随后分裂。雨水能使环境中的浓度回到最初水平,并可能在这个过程中溶解了一部分囊泡,然后在一定气候条件下,池塘或水池又开始蒸发,以进入蒸发诱导分裂和生长的下一个循环。

图2. 脂肪酸胶束形成双层脂肪酸囊泡。图片来源:Szostak Lab [3]
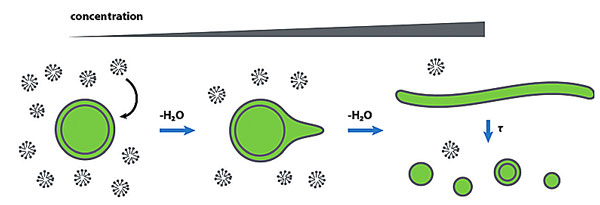
图3. 脂肪酸胶束在浓度差作用下进入脂肪酸囊泡膜,脂肪酸囊泡形成丝状结构并在温和剪切力或化学作用下分裂。图片来源:Angew. Chem. Int. Ed.[4]
同时,他们感兴趣的是其中是否存在某种形式的竞争性生长,以获得有限的膜成分。他们发现,第一个关于竞争性生长的线索来自于渗透性膨胀的脂肪酸囊泡。然而膨胀性囊泡生长会形成球体,球体难以分裂,这不符合原始细胞的特点。经过若干年探索,当他们研究原始细胞膜如何从单链两亲分子组成的原始膜进化到双链两亲分子组成的现代膜时,惊奇的发现,这些脂肪酸囊泡能够以相邻囊泡缺乏磷脂为代价生长。促使这一重要效应产生的机制有两个。(1)囊泡生长过程中磷脂稀释于熵值更有利;(2)双链磷脂诱导膜的有序性,阻碍脂肪酸从膜上解离,使得二者结合速率保持稳定。所以,膜中含有磷脂的囊泡倾向于通过吸收不含或少含磷脂囊泡的脂肪酸来生长。在这种情况下同样观察到囊泡生长成长丝状,进而被剪切诱导分裂。因此,任何可遗传的,催化磷脂合成的反应都能促使囊泡生长,并获得更大的竞争优势。磷脂诱导囊泡竞争性生长是一个很引人关注的过程。原因有几点:(1)这个过程不需要偶然性或周期性注入营养素,模拟条件更真实;(2)这个过程是竞争性的,所以原始细胞在较强选择性压力下,合成更高水平的磷脂符合达尔文进化论。此外,磷脂酸诱导囊泡竞争性生长这一过程可能诱导了原始细胞膜内代谢方式和膜转运机制的进化(图4,图5)。
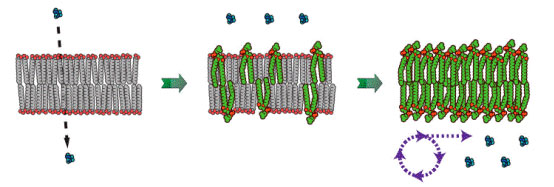
图4. 脂肪酸双层膜(左)在含有磷脂酸后(中,右)进化出选择透过性,能够竞争性生长。图片来源:Szostak Lab[3]

图5. 含磷脂酸的脂肪酸囊泡双层膜选择性透过核苷酸。图片来源:Szostak Lab[3]
由于磷脂合成的催化剂必须是可以遗传的,这就使得他们去探索是否存在RNA编码的核酶扮演这个角色,或者核酶合成的一种多肽催化剂在起作用?
Jack W. Szostak教授猜测原始细胞膜生物物理特性的变化,会启动具有遗传性的内部代谢路径的进化。他们对原始细胞RNA的复制过程进行了一系列研究,发现了令人惊奇的亲核共价催化(Covalent Nucleophilic Catalysis)模式。
任何进化过程要发生,必须保证有价值的功能性状能够遗传下去。由于RNA这类分子能兼具遗传性和功能性,所以备受学术界关注。早在上世纪六十年代末,以RNA为基础的功能基因组研究就已经出现,显然,RNA能够折叠形成复杂结构的特性,使得人们推测RNA可能具有催化功能。然而,这些想法石沉大海,直到上世纪八十年代早期又复活。这个时候,RNA酶在生物进化中的作用被直接观察到。所有研究焦点集中在由RNA催化RNA复制的可能性上,关于RNA作用于世界的假设诞生。随后几十年里,一些核酶的重要催化作用被发现,包括核酶可以直接进化为高效的RNA聚合酶,当然,这种酶还不足以单独完成RNA复制。
那么第一个核酶的诞生需要什么条件呢?Jack W. Szostak教授及其同伴猜测:不依赖酶催化的RNA复制,及化学或非酶RNA复制是这个过程初始阶段的关键步骤(图6)。活化单体如5'-磷酸化核苷酸使得RNA单链合成变得相对简单。例如,在地球早期环境中,活化单体可以在矿物质表面,或聚集在冰水晶体之间形成高浓度状态进而诱导随后的聚合反应。然而,RNA单链一旦形成,是如何在第一个酶出现之前复制的呢?解答这个问题是一个有趣却困难的挑战。事实上,要解答这个问题又回到了他们提出的猜想:在化学或非酶条件下如何促进RNA复制?回顾历史,这些研究工作在上个世纪六十年代就在开展了。从上个世纪七十年代到九十年代,Leslie Orgel课题组对此进行了深入研究,并取得了巨大进展 [5]。该课题组最重要的成就是发现2-甲基-磷酸-咪唑(2-methyl-phosphor-imid azolids)是模板介导的非酶引物延伸反应非常好的底物。而且短链、寡核苷酸C模板能够快速被活性G单体复制。然而,大家研究发现含四种核苷酸的混合序列模板几乎无法复制,除非是在与原始细胞环境不符合的特殊条件下进行。到上个世纪九十年代后期,RNA作用于世界的思想开始降温,大家开始寻找RNA替代者,希望另一些含遗传信息的分子能够更易于合成和复制,并在生命进化的某个后期阶段能被RNA逐渐取代。在这种指导思想下,多种核苷酸分子被合成出来以取代沃森-克里克碱基系统,这些研究表面上看百花齐放,异常繁荣,但是到目前为止,还没有发现一个比RNA合成或复制更高效的核苷酸分子。于是,Jack W. Szostak教授重新把目光放在RNA化学复制的领域上。在这个领域中,他们聚焦于如何以一种高效、普遍的方式来复制混合序列的RNA模板。这又是个问题中的问题,挑战中的挑战。虽然离彻底解决它尚远,但他们已经取得了重要进步。
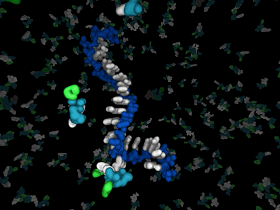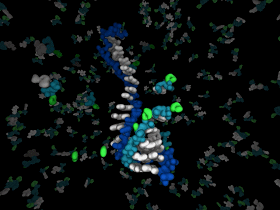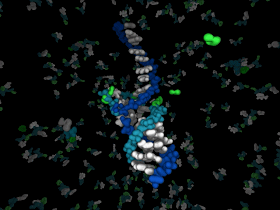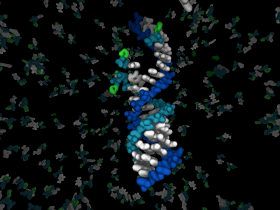
图6. RNA非酶复制的示意图。图片来源:Szostak Lab [3]
多少年来,引物与活化单体(如2-甲基咪唑 2-methylimidazolide)的反应被认为是一个经典SN2在线亲核取代(in-line nucleophilic)反应,引物的3'-羟基去进攻掺入核苷酸的磷,取代其甲基咪唑离去基团。然而,早期的实验也暗示这不是故事的全部。例如,在寡核苷酸C模板中,中间段核苷酸复制的更快,相比之下最后部分的核苷酸掺入要慢很多。1992年,Leslie Orgel课题组显示邻接引物的下游核苷酸序列扮演了重要的催化角色,他们甚至推测这种催化效应来自模板离去基团与单体的相互作用 [5]。不幸的是,这个有创意的观察没有后续结果,潜藏于其中的机理在随后25年里无人问津。戏剧性的是,多年后Jack W. Szostak教授课题组也遇到这个难题。他们想开发一个引物通过掺入单体延伸的替代反应,这是一个受生物学启发的RNA复制模型。Jack W. Szostak教授猜想:将单体组装成寡核苷酸短链,然后在模板介导下连接这些寡核苷酸链形成更长的寡核苷酸链,能够更高效完成模板复制,并能部分避免A和U之间的弱碱基配对问题,也能部分地为化学反应步骤提供更坚实的框架。为了验证这种猜想,他们比较了单体掺入和寡核苷酸连接两种情况下,RNA模板的复制速率,在实验设计上使得每种情况下化学步骤相同。他们使用了以G结尾的引物,掺入活化的G单体,或者含有相同活化5'-G残基的寡核苷酸,并监控两种情况下模板介导的引物反应(图7)。考虑到在A-型螺旋的几何构象中,引物和下游的寡核苷酸组织会更有序,他们猜测寡核苷酸掺入的连接反应会更快。然而,结果大大出乎他们的预料:单体掺入反应事实上比连接反应快100倍!25年后,他们又重新发现了Orgel早期的观察。在这点上,他们走得更远一点,发现整个下游的活化单体都是很好的催化剂,其中,短链的下游寡核苷酸催化效率更高,如活化三体能够提高催化速率1000倍。
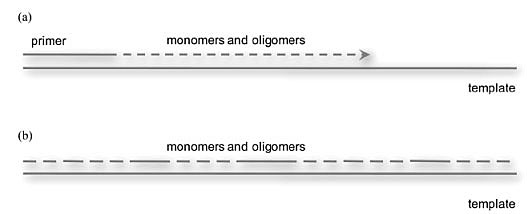
图7. RNA复制模型。(a)单体掺入的引物延伸;(b)单体、寡核苷酸连接。图片来源:Angew. Chem. Int. Ed. [4]
这一惊人的催化效率机制是怎样的?首先,他们推测是引物羟基与邻接单体离去基团2-甲基咪唑的非共价相互作用。分子动力学模拟计算显示邻接单体离去基团发生相互作用的潜在方式是多样化的,包括π-堆叠(π-stacking),阳离子-π(cation-π)和氢键相互作用(hydrogen bonding interactions)。然而,这类含咪唑底物的磷酸化同系物却不显示明显催化活性。他们对单体结合模板的晶体学研究同样没有发现离去基团任何非共价相互作用,研究陷入了困境。最后,是细致的动力学研究拯救了他们,使得他们重新回到正确的研究轨道上。他们尝试分析量化反应的动力学过程,却无法重复实验结果,这表明一些关键性常数没有得到很好的控制。此外,他们在标准条件下花费很多精力制备更纯的单体也无法解决问题。最终发现,这个隐藏于活化单体溶液中的变量是pH值。在单体加入前,引物延伸反应溶液的pH值是离去基团的pKa值,质子化和去质子化达到平衡。令人惊讶的是,在反应前孵育阶段处于最优pH值时,单体需要20分钟才能达到参与引物延伸反应的最佳状态。这个观察提示他们去寻找一种反应过程中积累的共价中间产物。随后进行的NMR实验迅速鉴定出一种咪唑-桥连二核苷酸(imidazolium-bridged dinucleotide),推测其可能是潜在的中间产物(图8)。对这个产物进行纯化后研究,显示其在引物延伸时高度活跃,且对中间产物的浓度监控,显示其形成足以影响所有的引物延伸。在Jack W. Szostak课题组研究的非酶引物延伸模式反应中,单体(或者活化协助者寡核苷酸)参与反应,首先形成一个咪唑-桥中间体。其次,引物3'-羟基进攻上游核苷酸的磷,取代整个下游的活化单体(或寡核苷酸),作为真正离去基团。
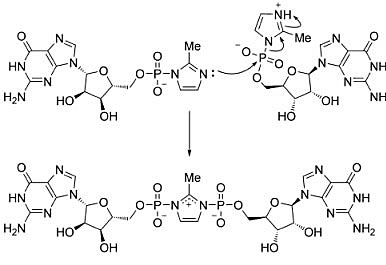
图8. 咪唑桥连二核苷酸的形成。图片来源:Angew. Chem. Int. Ed. [4]
他们认识到上游与下游单体在引物延伸反应中扮演不同角色,于是进行结构-活性关系(SAR)研究,筛选具有特殊下游催化活性的离去基团。小规模的咪唑基筛选显示2-位的取代基团小,pKa值高对反应更有利。他们在这些前提条件下,筛选出2-氨基咪唑(2-aminoimidazole)作为活性基团(图9)。研究发现无论是在上游还是在下游,2-氨基咪唑作为活性基团都要好于2-甲基咪唑。将这个新的活化基团结合到活化单体上,再加入活化三体,使得模板复制活性迅速增加。甚至含混合序列的模板也能延伸到七个核苷酸的地步。
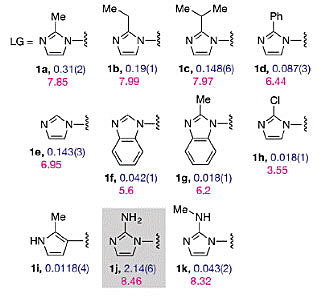
图9. 小规模离去基团筛选得到2-氨基咪唑。图片来源:JACS [6]
上述的所有自发引物延伸,都需要金属催化以达到显著速率。实验条件下,一般使用的是Mg2+,但是二价阳离子与反应中心的结合较弱,需要阳离子达到50-100 mM的高浓度水平。而高浓度Mg2+存在会产生严重问题。比如,高浓度二价阳离子能导致以脂肪酸为基础的膜迅速崩解,也能催化RNA的降解。那么,如何调和RNA复制需要高浓度金属离子催化与保持细胞膜稳定性和RNA完整性之间的矛盾呢?为了解答这个生命起源的难题,他们环环相扣,步步紧逼,从基础实验中寻找证据,从证据中提出新观点,随后进行验证,最后从原始生命角度来分析这样解决问题的合理性。首先,他们发现一种磷酸咪唑核苷酸不需要Mg2+也能聚合,并能在含脂肪酸的囊泡内进行模板介导的引物延伸。这是一个令人满意的步骤,显示膜内遗传系统连接过程没有受其它隐藏因素影响。第二步是另一个基础性的试验证据,表明在人工方式下,RNA化学过程与囊泡完整性能够兼容。第三步,他们考虑到筛选Mg2+螯合剂来解决问题。通过小规模筛选二羧酸、三羧酸类物质显示,柠檬酸螯合Mg2+能够保护脂肪酸膜不被Mg2+破坏,同时对催化RNA复制的干扰最小。他们在这些观察的基础上进行了一个多年前就想做的实验,在脂肪酸囊泡内复制RNA模板,这个囊泡大致认为可以生长和分裂。为了达到这个目的,他们首先把引物-模板复合物放入油酸囊泡中,纯化所有材料,随后加入Mg2+、柠檬酸和活化单体,这些物质都能自发穿模,促使引物在囊泡内延伸。实验结果令人振奋,柠檬酸有能力在囊泡内协助RNA复制(图9)。近期的研究还发现,柠檬酸能够增加脂肪酸膜对短链核苷酸的选择透过性[7]。
然而,早期原始细胞环境中不可能存在足够的柠檬酸。那么,扮演这个角色的替代者是什么?他们从生物学中得到了一个线索。细胞内最重要的酶之一RNA聚合酶,其核心位置存在一个小的多肽环。这个多肽环上有三个天冬氨酸残基,残基上的羧酸能调节具有催化功能的金属离子。这些富含天冬氨酸的多肽,是否扮演了柠檬酸的角色?在引物-模板-单体复合物中,有什么办法可以让这样的多肽靠近反应中心?这个“溯洄从之”的探索还在继续。
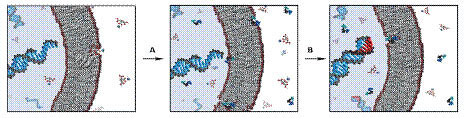
图10. 脂肪酸囊泡内的RNA模板复制。图片来源:Angew. Chem. Int. Ed. [4]
总结
如前所述,Jack W. Szostak课题组在探索生命的化学起源研究中,以含RNA序列的脂肪酸囊泡为模拟原始细胞。阐释了:(1)浓度差驱使原始细胞膜的生长和分裂机制;(2)原始细胞膜内的磷脂酸促进其竞争性生长;(3)RNA在引物介导下的非酶复制,是亲核取代反应,下游活化单体和三体有加速作用,并筛选到一个高效离去基团2-氨基咪唑;(4)RNA非酶复制过程中,pH值是关键性变量,反应会形成咪唑桥连二核苷酸中间产物;(5)柠檬酸作为Mg2+螯合剂,能够化解RNA复制需要高浓度Mg2+与高浓度Mg2+破坏原始细胞膜完整性并促进RNA降解的矛盾(图10)。在整合上述研究成果的基础上,他们进行了含混合序列RNA模板在模式原始细胞中的复制,用2-氨基咪唑结合的活化单体,配合活化的下游三核苷酸协助者,使用柠檬酸螯合Mg2+,在膜不受破坏的前提下,第一次完成含四个核苷酸的混合序列RNA非酶复制反应。
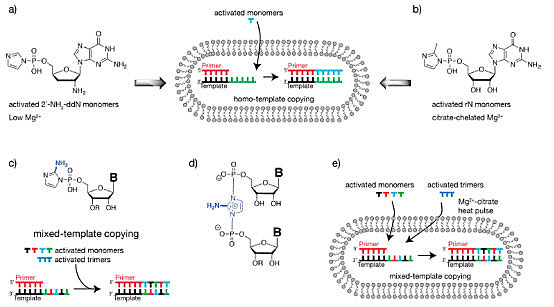
图11. 实验条件下模拟原始细胞内RNA复制。图片来源:JACS [7]
导师信息
Jack W. Szostak
https://www.x-mol.com/university/faculty/1395
参考资料:
1.https://www.nobelprize.org/prizes/medicine/2009/szostak/biographical/
2.https://cienciadelsur.com/2018/01/04/synthetic-life-jack-szostak-nobel-2009/
3.https://molbio.mgh.harvard.edu/szostakweb/
4. The Narrow Road to the Deep Past: In Search of the Chemistry of the Origin of Life. Angew. Chem. Int. Ed., 2017, 56, 11037, DOI: 10.1002/anie.201704048
5. Molecular replication. Nature, 1992, 358, 203, DOI: 10.1038/358203a0
6. Enhanced Nonenzymatic RNA Copying with 2-Aminoimidazole Activated Nucleotides, J. Am. Chem. Soc., 2017, 139, 1810, DOI: 10.1021/jacs.6b13148
7. Copying of Mixed-Sequence RNA Templates inside Model Protocells, J. Am. Chem. Soc., 2018, 140, 5171-5178.
(本文由水村山郭供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号