计算药学发现GPCR药物分子全新结合模式与激活机制
中国科学院深圳先进技术研究院(先进院)医药所计算机辅助药物设计中心袁曙光(点击查看介绍)课题组带领团队与上海科技大学合作,通过计算药学与生物化学相结合的方法,发现G蛋白偶联受体蛋白(GPCR)全新药物分子结合模式与激活机制(图1)。相关工作近期发表在化学类顶级期刊ACS Central Science (IF=12.8) 上。第一单位为中科院深圳先进院,主要通讯作者为袁曙光,程建军和武栋为共同通讯作者。第一作者为陈显翀,徐越溟与谭亮为共同一作。
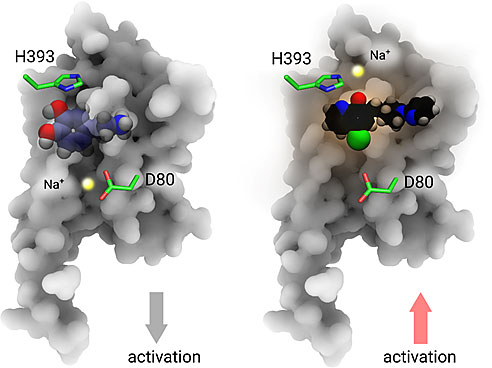
图1. GPCR全新药物分子结合模式
GPCR参与着人类各种生理功能,其中包括:细胞分化、神经信号传递、代谢等。GPCR也与人类重大疾病密切相关,包括:癌症、抑郁症、疼痛、艾滋病、糖尿病等。GPCR是最主要的药物靶标,将近40%的上市药物都针对GPCR而开发(图2)。因此,理解GPCR的分子机理成为当代药物研发中的核心课题之一。
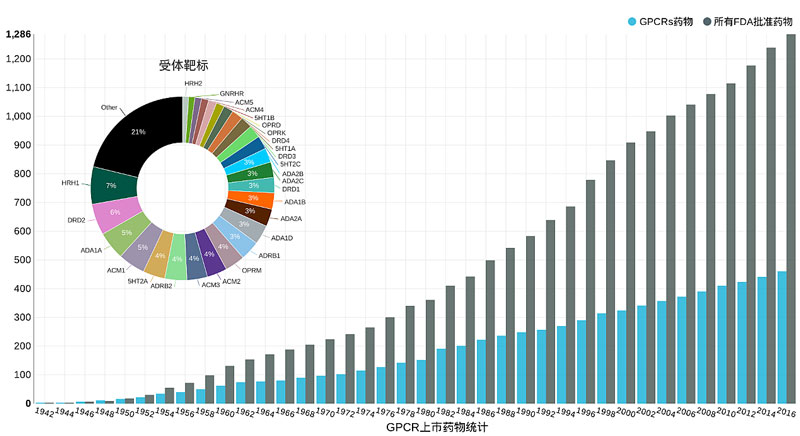
图2. GPCR上市药物统计
近年来,人们通过结构生物学、生物化学等手段发现金属离子,尤其是钠离子可以与GPCR第二跨膜螺旋上的一个保守的天门冬氨酸Asp(D2.50)结合,使得各个跨膜螺旋通过别构位点的(allosteric) 钠离子紧密结合,进而促使GPCR稳定在非激活状态。然而,也有报道表明:包括钠离子在内的一些金属离子,也可以使得GPCR的一些药物分子的活性大大增强,GPCR下游的信号通路也随之增强。但直到目前为止,还尚不清楚此类现象的分子机理。
本课题由袁曙光牵头,针对多巴胺D2受体,通过长时间尺度的全原子计算机模拟,首先捕获了钠离子与多巴胺D2受体第二跨膜螺旋上的一个保守的天门冬氨酸(D2.50)结合过程(图3)。
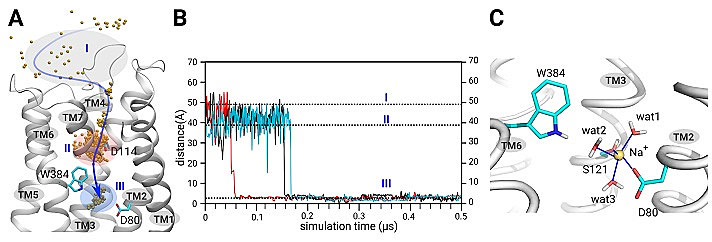
图3. 别构位点的钠离子被计算机模拟所捕获
接着,团队通过计算机模拟了D2受体与其激动剂MLS1547在细胞膜生理环境下的状态。计算机模拟结果显示,在正构位点(orthosteric site)区域,一个新的钠离子可以同时与D2受体上的组氨酸H393以及激动剂MLS1547芳环上的一个去质子化的酚羟基氧原子和一个叔氮原子形成配位键。此外,还有2个水分子也参与了与钠离子的配位过程(图4)。
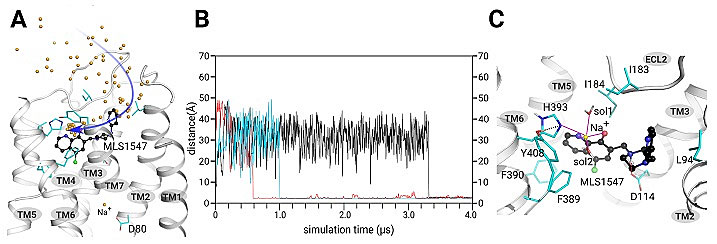
图4. 计算机模拟发现正构位点的钠离子并揭示GPCR全新药物分子结合模式
通过受体-药物分子相互作用指纹图谱,团队确定了与MLS1457相互作用的关键性氨基酸,并引入氨基酸定点突变。突变实验发现所有在指纹图谱中的氨基酸突变后对药物分子的活性影响非常巨大,甚至直接导致药物分子失活。突变实验强有力地佐证了计算机预测的新型结合模式的可靠性。值得一提的是,组氨酸H393并不直接与MLS1547相互作用,而是通过钠离子共同形成配位键参与作用。H393的突变也直接导致了药物分子完全失活,进一步有利佐证了这种全新药物分子与GPCR结合模式的合理性(图5)。此外,团队还通过对酚羟基氧原子对位取代的原子进行了化学合成的改造和修饰。通过调节其pKa来大大增强或者降低药物分子与D2受体的相互作用,从而进一步验证了全新结合模式的可靠性。
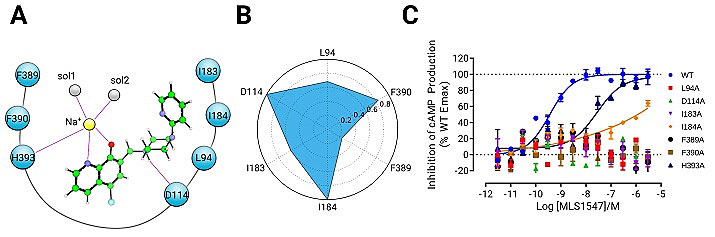
图5. 全新的药物结合模式被定点突变所佐证
此外,团队还重新解析了一个高分辨率的阿片受体的晶体结构。在此晶体结构当中,有一块未被原作者确定的电子云密度图 (unidentified electron density map)。团队通过尝试不同的原子模型和结构精修方法,以及考虑原作者实验过程中离子的来源,最终确定该区域属于一个镁离子的原子模型。有意思的是,该镁离子也处在正构位点区域,并同时与鸦片受体以及一个组氨酸HIS形成了配位键。这与团队在本工作中D2受体中发现的钠离子的相互作用方式非常相似。通过系统性地对GPCR的结构进行分析发现,在GPCR的正构位点区域,广泛分布着组氨酸。这意味着,在正构位点区域通过金属离子配位与GPCR残基侧链相互作用,极有可能可以在其他GPCR药物设计中普遍实现(图6)。
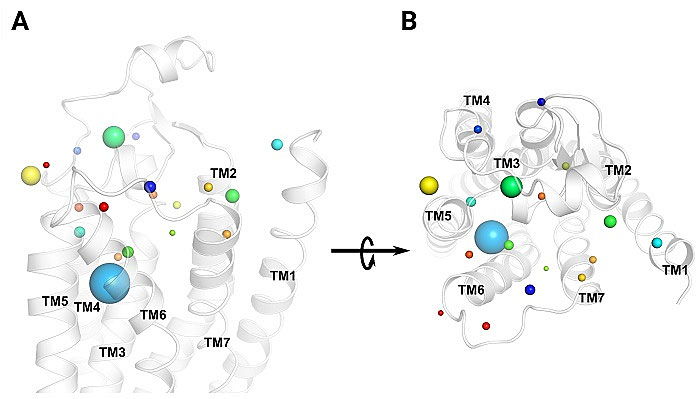
图6. 组氨酸HIS在GPCR正构位点的分布情况
本工作首次发现了金属离子可以在GPCR的正构位点与GPCR形成配位作用,揭示了GPCR激动剂的全新分子机理。本工作的发现为GPCR的药物设计以及药物分子活性优化提供了广阔的空间和全新的策略。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enhancing the Signaling of GPCRs via Orthosteric Ions
H. C. Stephen Chan, Yueming Xu, Liang Tan, Horst Vogel, Jianjun Cheng*, Dong Wu*, Shuguang Yuan*
ACS Cent. Sci., 2020, DOI: 10.1021/acscentsci.9b01247
主要通讯作者介绍
袁曙光,中国科学院深圳先进技术研究院研究员、计算机辅助药物设计中心中心主任、中科院百人、广东省珠江拔尖人才、华沙大学特聘荣誉教授、塞尔维亚国家科研基金国际顾问、欧盟FP7玛丽居里终身学者。袁教授硕士毕业于中科院上海有机化学研究所。其博士获得欧盟FP7玛丽居里全额奖学金资助,先后在欧洲三个国家共同完成博士学习:比利时鲁汶大学(KULEVEN)、波兰科学院和洛桑瑞士联邦理工学院(EPFL),并获得最佳博士论文奖。博士毕业后获得FP7旗下ETH博士后奖学金。此后在瑞士第三大制药公司Actelion (现在的Idorsia)工作5年。期间通过计算药学的方法设计出2个“first-in-class”新药分子进入临床一期,并获得全球范围内的落地新药专利。2019年4月,袁教授全职加入中国科学院深圳先进技术研究院。同年6月,袁教授依托先进院医药所带头组建“计算机辅助药物设计中心”,旨在针对人类重大疾病,通过计算药学的方法高效、精准筛选和设计临床前新药分子,为人类健康事业做出贡献。
袁曙光
https://www.x-mol.com/university/faculty/45898
学术主页
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号