“吸星大法”助力FLT3抑制剂开发
前不久驾鹤西游的金大侠在世纪新修版《笑傲江湖》中对任我行的“吸星大法”这样描述:源于逍遥派“北冥神功”正宗,但任教主独创融功法门将不同的内力“散入经穴,再汇而为一;那便多一分强一分了”。凭借吸星大法,少林三战中任教主赢了实力最强的方证大师,之后再度夺得日月神教教主宝座,走上了人生巅峰。而早在战国时期,荀子在其《劝学篇》中就点出,哥们不是生来就NB的,只是善于利用外物而已(“君子生非异也,善假于物也”)。由此可见,无论是先贤大哲还是武学宗师对采他山之石攻自己的玉器都是非常推崇的。在药物研发领域,这种做法尤其多见,毕竟从靶点发现验证到化合物发现优化再到临床前评价、临床试验和上市,不是谁都有钱有闲有能力可以独立玩转一条龙的。新药研发的复杂性和多风险性必然赋予它需要融合多学科跨部门的合作性质。今天,笔者想给大家分享的案例——FLT3抑制剂的发现,就属于“他山之石可以攻玉”的手法,以此为管,助大家窥见新药研发这只“豹子”的一斑。

任教主示范吸星大法。图片来自网络
大家知道急性髓细胞性白血病(Acute myeloid leukemia, AML)是所有白血病中恶性程度最高的一种,临床预后极差,五年总生存率不足26%,据统计仅美国每年新增病例14600例,死亡10400例。在AML所有基因改变事件中,FLT3(Fms-like tyrocine receptor kinase 3)是最常见的驱动因素。它主要有两种突变情况:大约三分之一的AML患者出现内部串联重复(FLT3-ITD),5-10%的AML有酪氨酸激酶域点突变(FLT3-TKD),尤其是活化环(activation loop)上D835残基突变,包括D835Y/H/V等点突变形式。
FLT3属于受体酪氨酸激酶(RTKs)家族class3成员,在造血干细胞、前体B细胞和NK细胞增殖、分化及凋亡中起重要作用,与其同族的c-kit、PDGFR和c-Fms同源性很高,因此FLT3抑制剂往往对这些激酶也有不同程度的抑制。如下图所示,跟其他酪氨酸激酶受体一样,FLT3激活后对其下游的PI3K-AKT、MEK-ERK等通路进行活化,促进细胞增殖。另外,还有一种定位于内质网膜上的FLT3(较典型的改变糖基化),可激活STAT5,后者转位入核后导致Pim激酶、Bcl-xL和CD1积累,抑制细胞凋亡。这“一推一拉”两方面共同施力,就使得AML快速恶化,难以控制。因此FLT3就成为治疗AML的关键靶点。
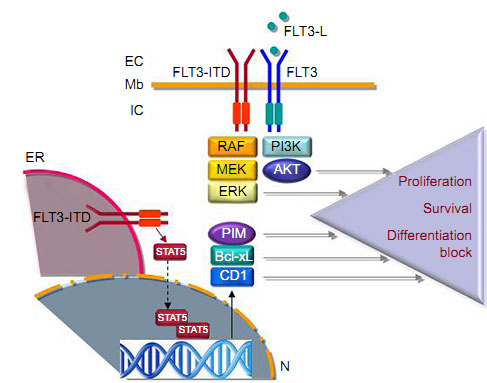
FLT3及FLT3-ITD信号通路。图片来源:OncoTargets and Therapy [1]
上面已经提到过了,FLT3和很多RTKs有着相似性,FLT3抑制剂往往对其他RTKs也有一定抑制,反过来亦然。因此,利用其他激酶抑制剂为模板开发FLT3抑制剂的例子比比皆是(如从CDK、BTK等抑制剂衍生)[2-3]。例如,华东理工大学李洪林教授课题组在研究EGFR抑制剂1时候,发现其对FLT3有中等抑制活性(IC50 = 312 nM),分子对接进行重叠显示其作用在EGFR和FLT3的模式很相似:例如嘧啶氨基与铰链区Cys694(FLT3)或Met793(EGFR)形成关键氢键,平面的并环母核处于疏水的“三明治”口袋中(FLT3:Ala642, Leu818; EGFR:Ala743, Leu844)。而它们最大的区别在于末端丙烯酰胺与EGFR Cys797巯基形成共价键(这就是对EGFR选择性的原因),而FLT3此位点上是位阻大的极性残基Asp698,这就产生不利的位阻作用 [4]。
基于这种结合模式,有两方面可以进行改进:一是除去产生位阻的丙烯酰胺(同时与EGFR失去共价结合),保留可作为氢键供体的氨基,也许可以提高FLT3抑制活性和选择性;二是观察到哌嗪侧链N与FLT3 Asn701有氢键作用,若在邻位引入基团产生构象限制作用,迫使N与Asn701更接近可增强氢键作用。为了验证设想,他们设计了化合物31,发现对FLT3抑制活性提高近200倍(IC50 = 1.56 nM),EGFR的抑制活性大大降低(IC50 > 10000 nM),或可避免长期用药产生的血管毒性。共晶结构显示,化合物31末端哌嗪N与Asn701距离较化合物1缩短,同时苯胺与Asp698形成较强的氢键,这都与之前设想一致。
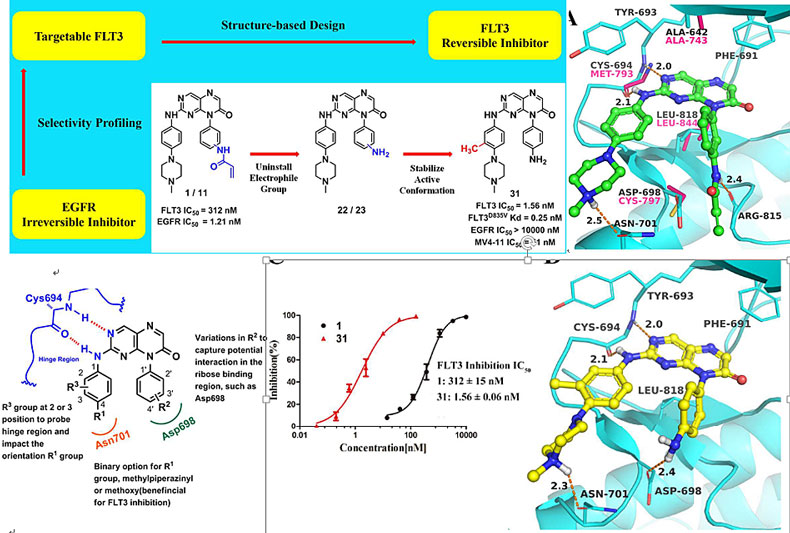
基于结构的FLT3抑制剂设计。图片来源:J. Med. Chem.
化合物31除了对野生型FLT3有强抑制外,对其典型的突变体FLT3-ITD、FLT3-D836V、ITD/D835V也有较强的抑制。抗增殖实验表明,对于FLT3表达的MV4-11和 FLT3-ITD依赖的Mdm13抑制明显比非FLT3依赖的细胞系(如THP-1、HL60、DMS79等)抑制强很多。Western blot进一步验证了化合物31对FLT3相关通路下游效应蛋白(STAT5、ERK、AKT)的去磷酸化效果成剂量依赖关系。
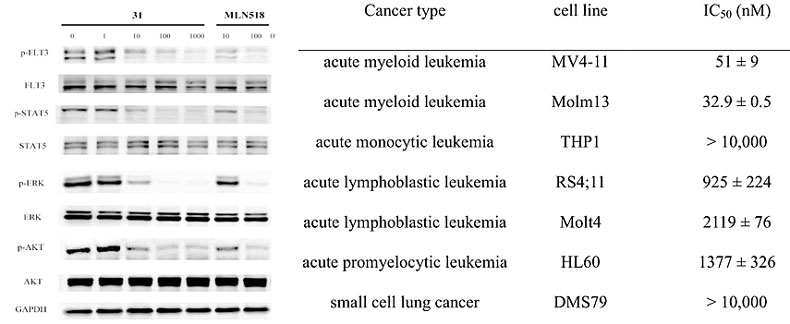
化合物31的抗增殖实验。图片来源:J. Med. Chem.
对于MV4-11荷瘤小鼠体内药效实验表明,存在明显的剂量-效应关系,在口服给药50 mg/kg时,肿瘤生长抑制(TGI)达到128%,表明肿瘤正在消退,与研发进展最快的第一三共开发的FLT3抑制剂AC220(Quizartinib,上市申请中)10 mg/kg的效果相当,并且小鼠体重正常,显示了一定安全性。
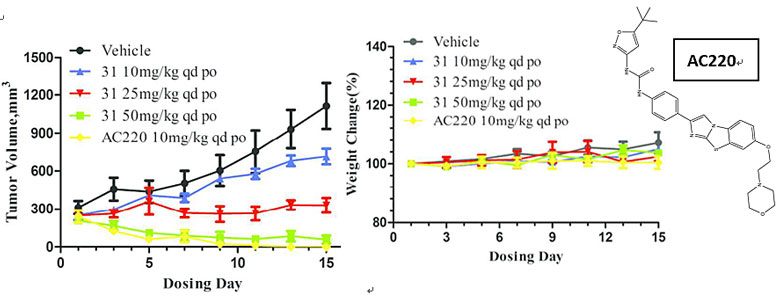
化合物31的体内药效试验。图片来源:J. Med. Chem.
结语:
不管“傅五条”多么值钱多么火,在新药研发的过程中,笔者认为只有一条金标准——满足未满足的临床需求。对于AML这种恶性程度高的疾病,尤其需要学界和工业界联手出击,至于“魔术子弹”出自何处,骨架新旧都是次要的,只要趁手的材料都可以使用。
另外可喜的是,上文提及的治疗AML的在研新药Quizartinib,今年5月份第一三共制药公司宣布其在关键3期临床试验中抵达主要终点。该研究显示,Quizartinib单一疗法与化疗相比,能够显著延长携带FLT3-ITD基因突变的AML患者的总生存期。如果一切顺利,Quizartinib或将成为全球首款上市的FLT3抑制剂。
参考文献:
1. Marie-Anne Hospital et al., FLT3 inhibitors: clinical potential in acute myeloid leukemia. Oncotarget and therapy, 2017, 10, 697. DOI: 10.2147/OTT.S103790
2. Zhihong Li et al., Discovery of AMG925, a FLT3 and CDK4 dual kinase inhibitor with preferential affinity for the activated state of FLT3. J. Med. Chem., 2014, 57, 3430.
3. Qingsong Liu et al., CHMFL-FLT3-213, as a highly potent typeII FLT3 kinase inhibitor capable of overcoming a variety of FLT3 mutants in AML. J. Med, Chem., 2017, 60, 8407.
4. Honglin Li et al., Discovery and rational design of Pterilin-7(8H)-one based inhibitors targeting FLT3 and its mutants. J. Med. Chem., 2016, 59, 6187.
(本文由西北望供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号