Angew. Chem.:具有近红外光增强催化活性的纳米酶用于深部胰腺癌的高效治疗
肿瘤微环境具有微酸、乏氧以及过氧化氢等代谢物普遍高于正常组织等特点。其中,肿瘤乏氧不仅会增强肿瘤细胞对化疗药的抵抗能力,同时也是肿瘤远端转移的主要诱因。自2007年Fe3O4纳米颗粒被首次报道具有过氧化物酶活性以来,纳米酶领域得到迅速的发展。纳米酶作为一种新型可控纳米催化药物,因兼具纳米材料的独特性质和天然酶的催化活性,在肿瘤催化治疗领域展现出了非凡的优势。基于肿瘤微环境响应的纳米酶肿瘤催化治疗策略受到研究者的广泛关注。然而,由于肿瘤微环境的乏氧以及高渗透压等问题,纳米酶的催化效率不尽如人意。如何巧妙设计纳米酶使其在肿瘤微环境下高效发挥催化活性至关重要。
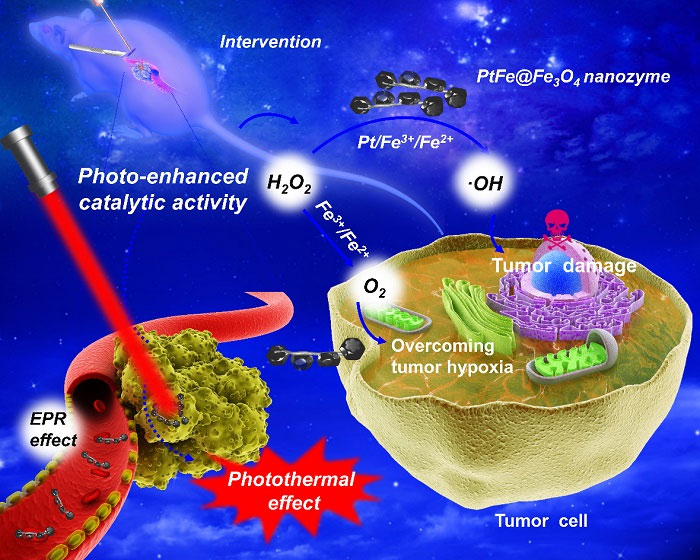
最近,北京化工大学刘惠玉教授(点击查看介绍)团队与中国科学院理化技术研究所张铁锐研究员(点击查看介绍)团队合作,构建了一种具有肿瘤微环境响应性的新型纳米酶(PtFe@Fe3O4)。作为过氧化氢(H2O2)响应性纳米酶,PtFe@Fe3O4能够同时分解H2O2产生氧气和羟基自由基,克服肿瘤乏氧环境并实现对肿瘤细胞的有效杀伤。
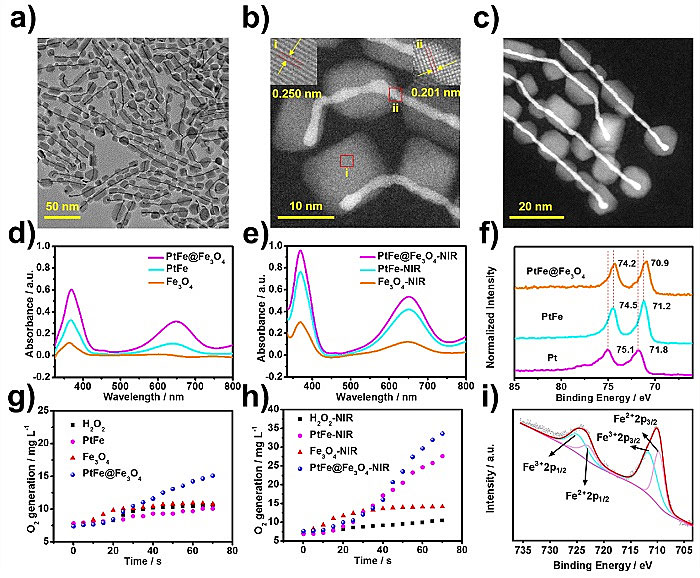
相比于Fe3O4,PtFe@Fe3O4的类过氧化物酶活性最大反应速率Vmax以及产氧速率分别提高了1.3倍和1.4倍。重要的是,在808 nm激光照射下,PtFe@Fe3O4的催化活性得到显著增强。此外,PtFe@Fe3O4纳米酶可能的催化机制被进一步揭示。在该催化过程中,Fe3O4充当电子泵的作用,使Pt处于富电子状态,从而实现增强的催化活性。在近红外光的刺激下,由于PtFe表面等离子共振的存在,其催化活性进一步地得到提升。在体内治疗实验中,利用光纤介入的手段,实现了体内原位增强的双酶活性,结合材料本身的光热效应,实现了深部胰腺癌的高效治疗。这项工作将为探索新型的纳米酶基肿瘤催化治疗策略开辟新的视野。
相关结果发表Angewandte Chemie International Edition 上,文章的第一作者是北京化工大学硕士研究生李闪闪和理化研究所副研究员尚露,通讯作者为刘惠玉教授和张铁锐研究员。该研究得到了国家重点研发计划、国家自然科学基金委以及中央高校基本科研业务费等专项经费的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Nanozyme with Photo-Enhanced Dual Enzyme-Like Activities for Deep Pancreatic Cancer Therapy
Shanshan Li, Lu Shang, Bolong Xu, Shunhao Wang, Kai Gu, Qingyuan Wu, Yun Sun, Qinghua Zhang Hailong Yang, Fengrong Zhang, Lin Gu, Tierui Zhang, Huiyu Liu
Angew. Chem. Int. Ed., 2019, DOI: 10.1002/anie.201904751
导师介绍
刘惠玉
https://www.x-mol.com/university/faculty/44730
张铁锐
https://www.x-mol.com/university/faculty/15670
(本稿件来自Wiley)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!













































 京公网安备 11010802027423号
京公网安备 11010802027423号