Jacobsen组Science:氢键供体增强的Lewis酸用于不对称催化反应
利用有机分子作为氢键供体与亲电底物产生氢键相互作用来设计催化反应的研究可追溯至上世纪80年代,但直至2002年,美国哈佛大学的Eric Jacobsen教授才通过理论计算与实验具体阐明了这一作用机制。他们设计了硫脲催化芳香及脂肪亚胺的不对称Strecker反应,并结合核磁共振表征、动力学分析以及理论计算等研究,提出硫脲官能团中的两组质子可通过双氢键相互作用活化亚胺,由此产生催化活性。在该工作的基础上,人们发展了不同的氢键供体有机分子用于设计对映选择性的催化反应。这些催化剂分子中包含脲、硫脲、胍或方酰胺等基团,可通过非共价双氢键相互作用与底物特异性结合,进而借助分子内其他手性结构诱导不对称催化过程。
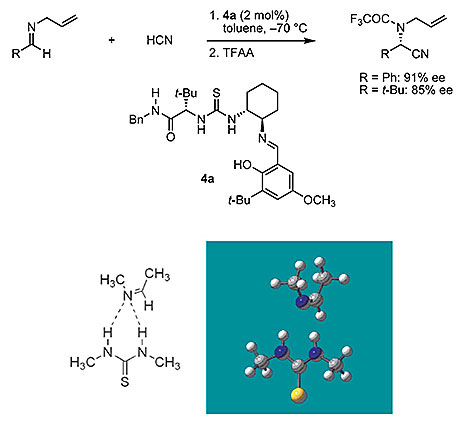
图1. 硫脲催化芳香及脂肪亚胺的不对称Strecker反应。图片来源:Chem. Rev., 2007, 107, 5713
对于氢键供体催化剂参与的对映选择性亲核反应,催化剂分子可通过两组质子与电中性的亲电底物直接作用(Direct Activation)、攫取底物中的离去阴离子形成离子对中间体(Anion Abstraction)或结合其他Brønsted酸产生的共催化作用(Brønsted Acid Co-Catalysis)等方式促进反应进行。然而该类催化剂中质子的Brønsted酸性较弱,所产生的非共价相互作用十分有限,反应仅适用于含有高度反应活性C-X(X = 杂原子)键的底物,大大限制了该类催化剂在不同催化反应中的应用。
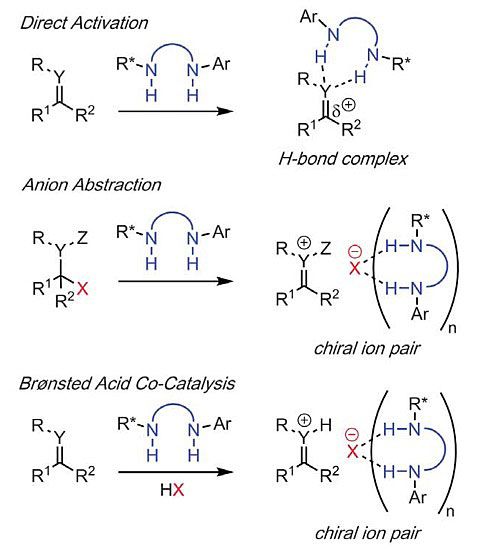
图2. 氢键供体催化剂的催化作用方式。图片来源:Science
最近,哈佛大学的Eric Jacobsen教授(点击查看介绍)课题组以手性的方酰胺作为氢键供体催化剂,结合Lewis酸三氟甲磺酸硅酯实现了低温条件下热力学稳定的缩醛与烯醇硅醚等不同亲核试剂的不对称亲核烷基化以及与双烯体呋喃的[4+3]对映选择性环加成反应。方酰胺基团的两组质子与三氟甲磺酸硅酯中含有部分负电荷的OTf δ-作用形成稳定的络合物中间体,从而增强三氟甲磺酸硅酯的Lewis酸性,促进缩醛转化为活性更高的羰基碳鎓阳离子中间体。该物种与攫取阴离子OTf-后的方酰胺形成离子对中间体,与此同时,方酰胺修饰的手性基团可通过这种非共价相互作用实现手性控制。相关工作发表在Science 上。
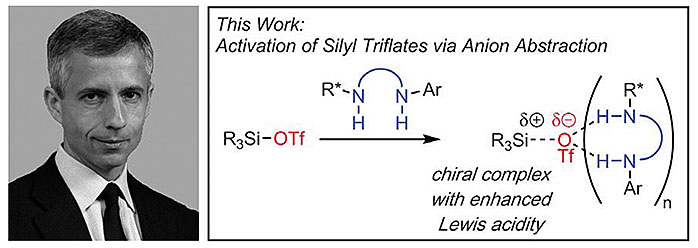
图3. Eric Jacobsen教授发展的氢键供体增强的Lewis酸催化体系。图片来源:Science
三氟甲磺酸硅酯作为一种常见的Lewis酸在有机合成反应中具有十分重要的应用,早期人们便通过调整硅酯的抗衡阴离子,削弱其对硅正离子中心的配位能力,由此提高Lewis酸的催化活性,实现了温和条件下α,β-不饱和酸酯与共轭二烯的外消旋Diel-Alder反应。随后,德国马克斯•普朗克煤炭研究所的Benjamin List教授研究团队设计了手性双磺酰亚胺阴离子结合硅正离子物种,形成的强Lewis酸可实现室温及低温下多种不同底物的对映选择性催化过程。Eric Jacobsen教授在以往工作的基础上,设想通过手性氢键供体与三氟甲磺酸硅酯结合,削弱OTf-阴离子对硅正离子中心的配位作用来增强Lewis酸的酸性,进而设计一系列的不对称催化反应。
作者首先对热力学稳定的缩醛参与的Mukaiyama Aldol反应进行尝试,考察了不同手性氢键供体催化剂与三氟甲磺酸硅酯结合后的催化活性。手性方酰胺(5e)结合TBSOTf,在-78 ℃的低温条件下可促进4-溴苯甲醛二苄基缩醛(1a)转化为相应的羰基碳鎓阳离子,随后与烯醇硅醚发生Mukaiyama Aldol反应,以几乎化学计量的收率及良好的对映选择性得到目标产物。而单独使用TBSOTf或结合脲、硫脲等其他氢键供体催化剂形成的Lewis酸不具有明显的催化活性。当方酰胺的两组质子被甲基取代时,反应的产率大幅度降低,且仅能得到外消旋的产物。由此说明,取代的方酰胺可作为Lewis碱与硅正离子中心部分结合提高Lewis酸性,但方酰胺的氢键作用对控制反应的立体化学具有十分重要的影响。在优化条件下,不同亲核试剂均可以顺利地参与对映选择性的烷基化反应。

图4. 方酰胺结合Lewis酸TBSOTf催化的不对称亲核烷基化反应。图片来源:Science
随后他们又尝试利用该催化体系发展缩醛与双烯体(如呋喃)的[4+3]环加成反应。硅氧基乙烯缩醛作为底物可在方酰胺5e/TESOTf的协同催化下原位生成氧代烯丙基阳离子活性中间体,进而与呋喃在低温条件下发生[4+3]环加成,以良好的收率和对映选择性得到单一的非对映异构体产物。反应对不同官能团均具有良好的兼容性。
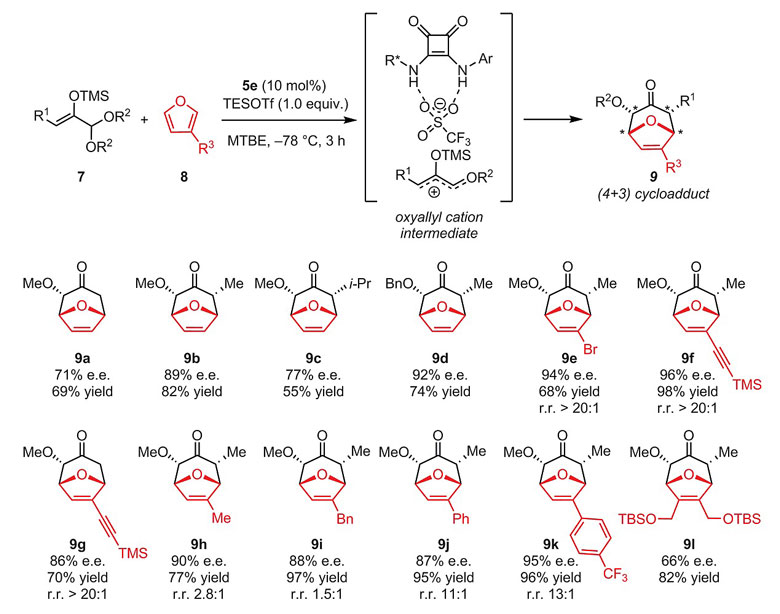
图5. 方酰胺结合Lewis酸TESOTf催化的对映选择性[4+3]环加成反应。图片来源:Science
作者还对[4+3]环加成反应进行了动力学分析,通过原位红外光谱实验实时跟踪反应的速率。反应对硅氧基乙烯缩醛和方酰胺分别呈一级,对呋喃则呈零级,对TESOTf表现出饱和动力学的特征。这种测试结果说明,方酰胺手性供体催化剂与TESOTf首先形成休眠态复合物,并快速达到平衡,该中间体与缩醛反应是整个过程的决速步骤。为了了解这种休眠态复合物的组成,他们还通过TESOTf对方酰胺5g的核磁共振波谱滴定实验确定两者以1:1的比例结合,原位红外光谱分析也表明,滴定过程中方酰胺羰基基团的特征吸收峰逐步减弱并消失。相比于NBu4OTf等其他三氟甲磺酸盐,TESOTf与5g的结合常数显著提高,暗示反应初始阶段TES δ+与OTf δ-两者均与方酰胺产生结合作用,该结论同样也通过甲基化的方酰胺6g与TESOTf的结合常数得到证实。作者进一步对TESOTf与5g形成的络合物进行了密度泛函理论(DFT)计算,其中OTf δ-与两组质子几乎呈对称相互作用,TES δ+则与方酰胺中的羰基共价相连,由此也解释了TESOTf与5g具有显著增强的结合作用。
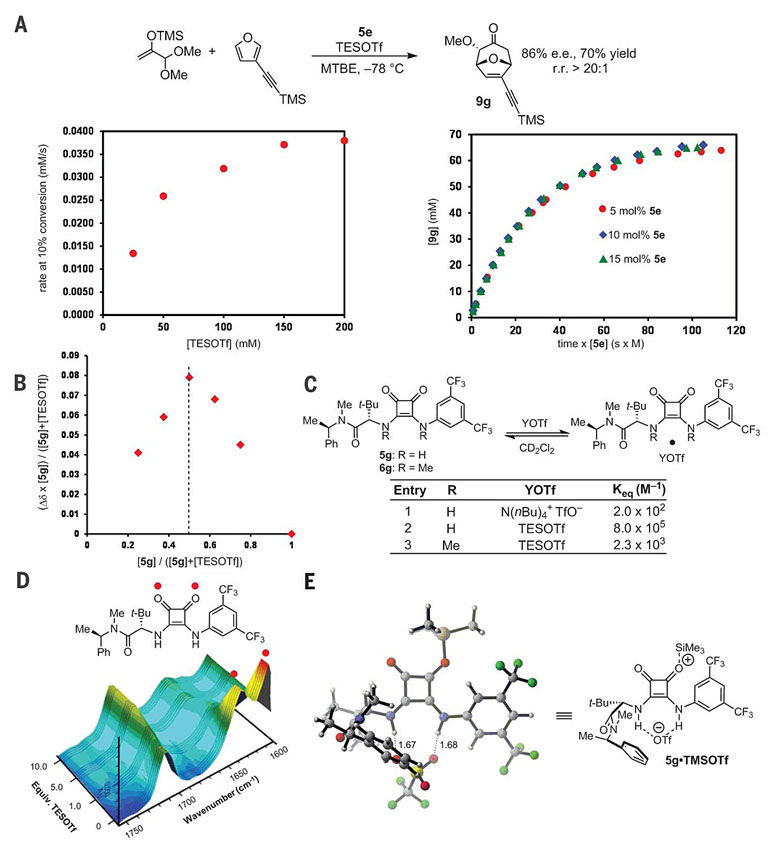
图6. [4+3]环加成反应的机理研究。图片来源:Science
结合以上实验,他们提出的反应机理如下:三氟甲磺酸硅酯与方酰胺通过非共价氢键相互作用形成休眠态复合物,并作为Lewis酸促进缩醛形成高反应活性的阳离子中间体,进而与烯醇硅醚等亲核试剂以及双烯体呋喃发生反应。对于[4+3]对映选择性环加成反应,DFT计算支持分步反应机理,呋喃作为亲核试剂首先对形成的氧代烯丙基阳离子的烯基末端亲核加成,随后发生环化。该过程也成为立体选择性控制的关键,反应中可能经历两种过渡态,其中呋喃与方酰胺催化剂的芳香环取代基可通过π-π相互作用加以稳定,因而成为优势过渡态,呋喃从邻近催化剂芳香环的区域对氧代烯丙基阳离子进行亲核加成。
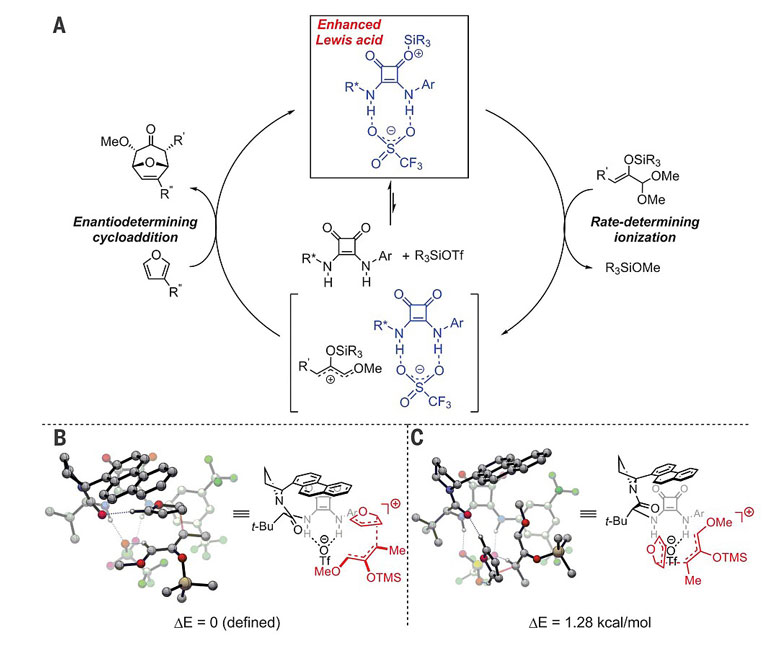
图7. 反应可能的机理。图片来源:Science
——总结——
Eric Jacobsen教授研究团队通过手性方酰胺氢键供体催化剂与Lewis酸结合,实现了热力学稳定的缩醛参与的不对称亲核烷基化以及[4+3]对映选择性环加成反应,由此突破了氢键供体催化剂仅可用于高反应活性底物的限制,大大拓展了底物的适用范围。这种氢键供体分子与Lewis酸中的阴离子结合,进而提高Lewis酸反应活性的策略对设计其他新型的组合催化体系具有重要的借鉴意义。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Lewis acid enhancement by hydrogen-bond donors for asymmetric catalysis
Science, 2017, 358, 761, DOI: 10.1126/science.aao5894
导师介绍
Eric Jacobsen
http://www.x-mol.com/university/faculty/26725
参考内容:
http://science.sciencemag.org/content/358/6364/720
(本文由夜若岚尘供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号